发布时间:2025-05-06 浏览量:0
前言
INTRODUCTION
血管再生是人体应对缺血、创伤等损伤的关键修复过程,对于维持组织器官的正常功能至关重要。传统的血管再生策略如血管移植、生长因子治疗等存在诸多局限性。外泌体作为一种新型的细胞间通讯介质,携带着丰富的生物活性分子,能够精准调控细胞行为。在血管再生研究中展现出巨大潜力,为缺血性疾病的应对开辟了新途径。

外泌体起源于细胞内吞过程形成的多泡体(multivesicular bodies,MVBs),MVBs与细胞膜融合后将内部的小囊泡释放到细胞外环境,这些直径约30-150nm的纳米级囊泡即为外泌体。其形成过程受到多种蛋白质如Rab家族蛋白、ESCRT复合体等的精细调控。
外泌体富含蛋白质(如细胞骨架蛋白、膜转运蛋白、热休克蛋白等)、核酸(mRNAs、miRNAs、lncRNAs等)和脂质(鞘磷脂、胆固醇等)。这些成分反映了母体细胞的生理状态,来自母体细胞的外泌体通常以内吞作用、直接膜融合和受体-配体相互作用的方式,进一步递送到靶细胞并在靶细胞中发挥特定功能[1](图一)。
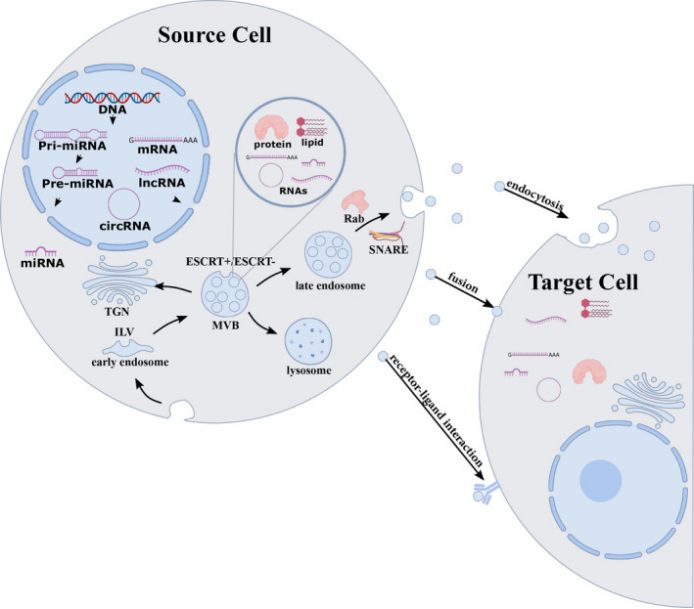
图一:外泌体的生物发生、装载和分泌示意图。
间充质干细胞(MSCs)外泌体
间充质干细胞(MSCs)是血管再生研究中最常用的细胞来源之一,其外泌体同样具有强大的促血管再生能力。MSCs外泌体可以通过上调促血管生成因子,如血管内皮生长因子(Vascular endothelium growth factor,VEGF)、血小板源性生长因子(Platelet-derived growth factor,PDGF),直接刺激血管内皮细胞增殖、迁移,加速血管形成。研究表明,在心肌梗死模型中,给予MSCs外泌体治疗后,梗死区域周边血管密度增加约40%,同时心脏射血分数提高15-20%,显著改善心脏功能[2]。
内皮祖细胞外泌体
内皮祖细胞(EPCs)在血管再生中起重要作用,其外泌体同样关键。EPCs外泌体不仅含有促血管生成物质,还携带调节内皮细胞功能的特异性蛋白,如 eNOS等,促进一氧化氮生成,舒张血管,为新生血管营造良好环境[3]。此外,EPCs外泌体传递的miRNAs可调节靶细胞的基因表达,提高内皮细胞增殖、血管生成和迁移能力,促进新血管生成[4]。
肿瘤细胞外泌体
与正常细胞来源的外泌体不同,肿瘤细胞分泌的外泌体在肿瘤血管生成中扮演复杂角色。一方面,携带促血管生成因子如VEGF、PDGF等,刺激肿瘤周边血管异常增生,为肿瘤生长、转移提供营养支持;另一方面,通过传递miRNAs等改变肿瘤微环境中内皮细胞、免疫细胞等的功能,促进肿瘤免疫逃逸与血管生成的协同发展,给肿瘤治疗带来挑战[5]。
心肌梗死
心肌梗死后心肌组织缺血缺氧,急需血管再生修复。MSCs外泌体、EPCs外泌体等应用于心肌梗死动物模型,可通过上调促血管生成因子促进新血管形成,减少心肌纤维化,提高心脏射血分数,介导外泌体对心脏的保护作用[2, 6](图二)。
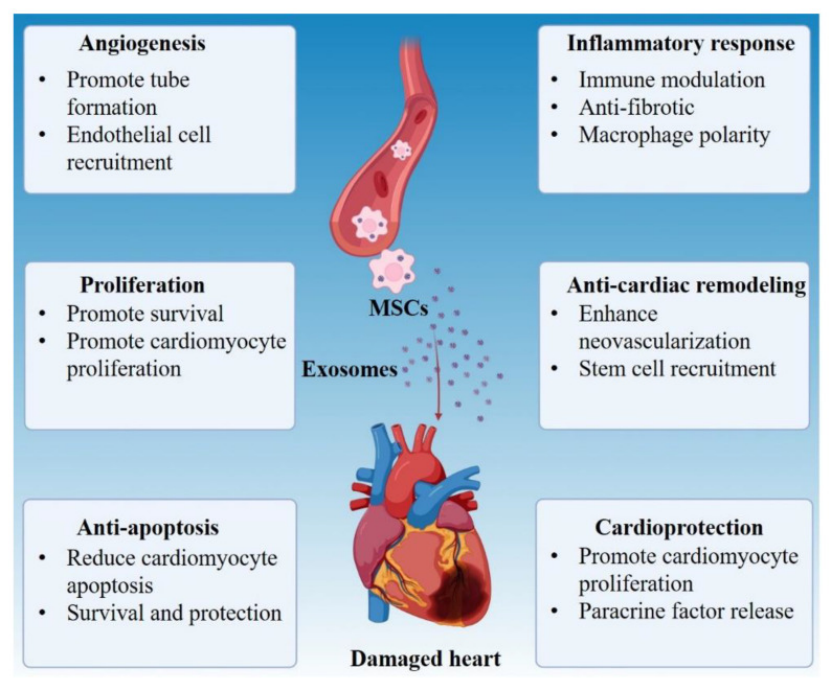
图二:外泌体通过多种不同机制用于心脏修复治疗示意图。
缺血性脑卒中
在脑卒中模型中,外泌体能够穿越血脑屏障,到达缺血半暗带,促进脑血管再生,挽救受损神经元,减轻神经功能缺损。这其中例如,神经干细胞外泌体携带的脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)可以抑制小胶质细胞的活化,促进内源性神经干细胞向神经元的分化,为神经血管单元的修复提供助力[7](图三)。
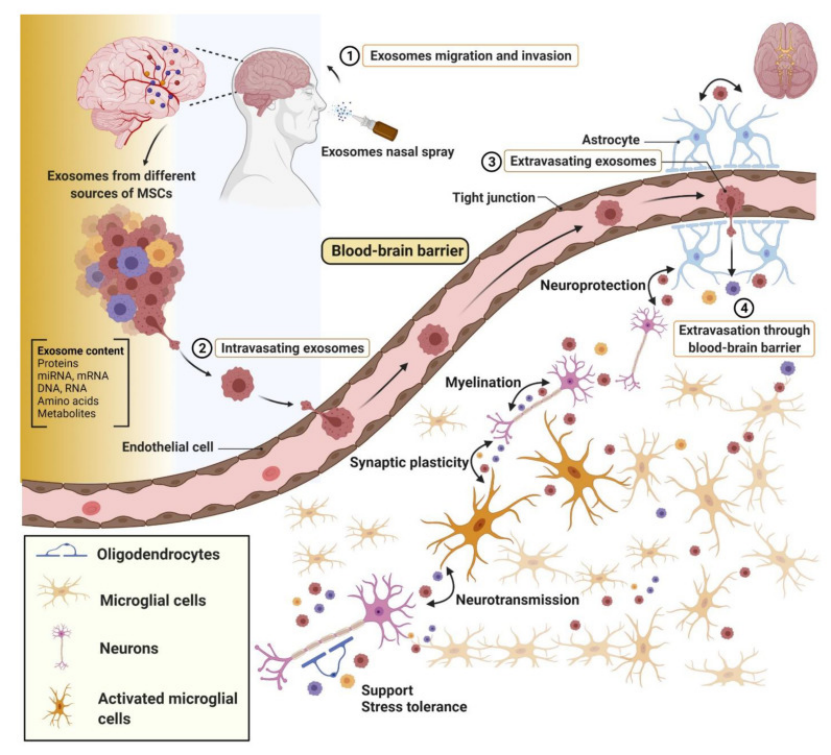
图三:外泌体在神经细胞通讯中的功能示意图。
糖尿病足
糖尿病足又称糖尿病肢端酸坏疽,是由神经病变和周围血管病变引起的下肢皮肤慢性难愈性溃疡、感染或深部组织破坏,严重者可导致截肢,给患者带来巨大痛苦[8]。而间充质干细胞来源的外泌体可以通过促进微血管内皮细胞和成纤维细胞增殖与迁移,抑制细胞凋亡和炎症反应,促进创面血管再生,提高创面愈合速度,缓解患者痛苦,降低截肢风险[9-11](图四)。
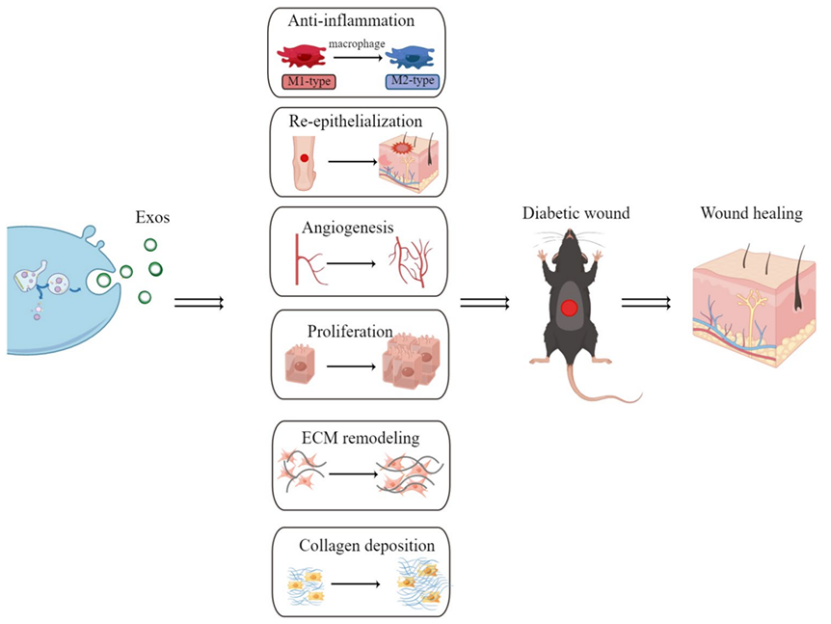
图四:外泌体通过不同机制有效修复糖尿病足,显著促进组织再生机制图。
外泌体在血管再生领域已取得显著进展,不同来源外泌体通过多种机制促进血管再生,在缺血性疾病模型中展现出良好疗效。然而,临床转化仍面临着外泌体分离纯化技术尚不统一,体内代谢机制不明,靶向性有待提高等挑战。未来,随着技术的进步,相关研究者开发出高效的外泌体工程化技术,实现精准靶向、建立标准化制备流程,使外泌体有望成为血管再生治疗的有力武器,为心血管疾病、缺血性疾病等提供全新的治疗策略。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。

