发布时间:2025-06-04 浏览量:0
前言
INTRODUCTION
在肿瘤治疗的前沿领域,嵌合抗原受体 T 细胞(CAR-T)疗法近年来取得了突破性进展,成为应对恶性血液系统病症的重要研究方向。
2012 年,艾米丽・怀特海德接受 CAR-T 细胞干预后,其急性淋巴细胞病症(ALL)获得长期改善,这一成功案例开启了 CAR-T 技术的全新研究阶段。在 CAR-T 技术不断发展的同时,一个与之紧密相关且极具潜力的研究对象进入了人们的视野 —— 外泌体。作为细胞间通讯的重要介质,外泌体正逐渐成为 CAR-T 细胞技术研究的热门方向。
外泌体是直径 30 - 150nm 的细胞外囊泡,携带蛋白质、核酸和代谢物等物质。在某些情况下,外泌体可以作为主要组织相容性复合体(MHC)的多肽来源,用于抗原呈递和适应性免疫系统的启动,为进一步应对各种自身免疫性和复杂病症开辟许多途径。T 细胞来源的外泌体,特别是 CAR-T 细胞分泌的 CAR 外泌体,其纳米级别的尺寸赋予它独特优势,CAR外泌体能更轻松地穿透实体病灶的细胞外基质和血脑屏障,这是体积较大的 CAR-T 细胞难以做到的。
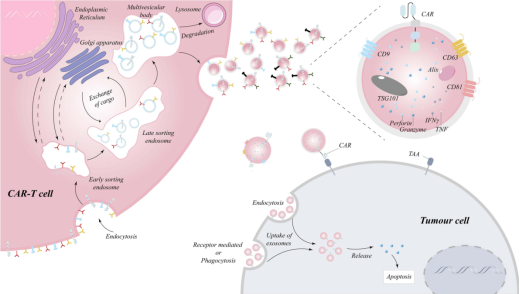
图 CAR-T 细胞释放的外泌体的生物发生和作用机制 [3]
在肿瘤应对方面,CAR外泌体携带与母细胞相同的CAR及大量细胞因子,在体外实验和动物模型中均表现出强大的抗肿瘤活性。其纳米级尺寸使其能更有效地穿透实体肿瘤的细胞外基质和血脑屏障,为肿瘤的治疗带来新希望。研究表明,靶向间皮素的 CAR-T细胞外泌体在小鼠乳腺癌模型中,能够有效地抑制肿瘤生长[1]。此外,研究显示,CAR 外泌体还可能具备一定的携带抗癌药物并实现靶向递送的能力。在非小细胞肺癌小鼠模型的实验中,通过吸入携带紫杉醇的CAR 外泌体,成功减小了肿瘤体积,并且延长了小鼠的生存期[2]。

在安全性方面,CAR 外泌体也展现出研究价值。CAR-T 细胞疗法虽取得显著成果,但常出现细胞因子释放综合征(CRS)等不良反应,而现有研究中,注射 CAR 外泌体尚未观察到这些情况。实验表明,将 CAR-T 细胞和 CAR 外泌体分别注入小鼠乳腺癌模型后,随着 CAR-T 细胞给予剂量的增加,小鼠出现抑制行为、体重减轻、活动能力降低和毛囊勃起的现象呈剂量依赖效应;相比之下,CAR 外泌体未引发明显的行为或体重改变 [4] 。
1、细胞毒性物质传递
研究表明,CAR 外泌体继承了 CAR-T 细胞的细胞毒性特质,含有丰富的细胞毒性颗粒,如穿孔素和颗粒酶。当接触病灶细胞时,穿孔素在病灶细胞膜上形成小孔,使颗粒酶进入细胞内部,激活凋亡相关蛋白,启动病灶细胞凋亡程序,直接作用于病灶细胞,与 CAR-T 细胞的作用机制协同,或能增强对抗肿瘤的效果。
2、免疫调节
CAR 外泌体可对病灶微环境中的免疫细胞功能产生影响。研究显示,它能激活自然杀伤细胞(NK 细胞)、巨噬细胞等免疫细胞。例如,CAR 外泌体表面的特定抗原信息被 NK 细胞识别后,可能激活 NK 细胞,增强其对病灶细胞的作用活性;还可能促进巨噬细胞向具有对抗病灶活性的 M1 型极化,提高吞噬能力。此外,CAR 外泌体分泌的细胞因子,如干扰素 -γ(IFN-γ)、白细胞介素 - 2(IL-2)等,激活 T 细胞、B 细胞等免疫细胞,促进免疫细胞增殖和分化,增强机体对抗病症免疫反应,与 CAR-T 细胞激活免疫系统的过程相互配合。
3、病灶抗原呈递
CAR 外泌体将病灶抗原呈递给抗原呈递细胞(APC),如树突状细胞(DC)。DC 细胞摄取 CAR 外泌体后,加工处理病灶抗原,并呈递给 T 细胞,激活 T 细胞免疫应答。研究显示,这种抗原呈递方式不仅或能激活 CAR-T 细胞,还可能扩大免疫反应范围,增强免疫系统对病灶细胞的识别和作用能力。
尽管 CAR 外泌体逐渐展现出广阔的研究前景,但目前在临床转化过程中仍面临诸多挑战。例如外泌体的分离和纯化技术尚不完善,现有的免疫亲和捕获、尺寸排阻色谱、超滤和超速离心等方法各有优劣。组合方法虽能提高产量和纯度,但存在成本高、耗时长的问题。

此外,研究发现,CAR 外泌体可能与免疫细胞相关神经毒性综合征(ICANS)的发生存在关联。研究显示,ICANS 患者体内 CAR 外泌体水平更高,其与神经元共培养时会引发神经元应激标记物释放增加。CAR 外泌体水平或许可作为预测 ICANS 发生的指标,但在 ICANS 发病机制中的具体作用仍有待深入研究。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。

