发布时间:2021-04-01 浏览量:0
1、国家卫健委明确表态:鼓励和支持干细胞免疫细胞等研究、转化和产业发展

近日,国家卫健委在官网上发布了《对十三届全国人大三次会议第4371号建议的答复》。
答复函中明确提出:
二、关于支持推动示范区干细胞治疗、细胞免疫治疗等医疗技术的临床应用
我委一直鼓励和支持干细胞、免疫细胞等研究、转化和产业发展。干细胞、免疫细胞等细胞制剂具有明显的药品属性。国家药品监管部门已经为相关制剂通过药品审批制定配套政策,审批后可以迅速广泛应用,既有利于保障医疗质量安全,又有利于产业化、高质量发展。
下一步,我委将积极支持、引导北戴河生命健康产业创新示范区相关企业按照药品研发相关制剂。
三、关于支持示范区先行试用国外已上市、国内未注册医疗器械
2019年以来,我委积极配合国家药监局等主管部门在放宽特定区域医疗设备和药品准入政策等方面推进相关工作。加快海南博鳌乐城国际医疗旅游先行区药品的进口审批;放宽粤港澳大湾区药品准入限制,允许在大湾区内地9市开业的港澳资医疗机构使用已在港澳地区获准使用的药品。
来源:2021年3月1日干细胞
2、NK细胞疗法火热:赛诺菲、默沙东等巨头抢滩,投资交易不断
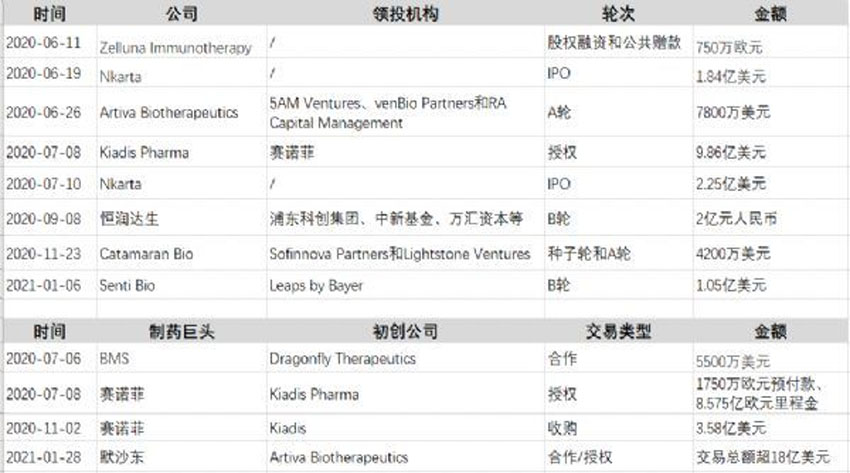
自然杀伤(NK)细胞正在成为蓬勃发展的癌症细胞治疗领域的热门话题。像T细胞一样,NK细胞可以被改造以更好地识别特定的肿瘤。此外,它们还有几个优点:一是NK细胞能比T细胞检测到更多的肿瘤化学信号。另一个是与T细胞相比,NK相对不容易攻击健康组织。这意味着可以用来自健康供体的NK细胞治疗患者,并降低外来细胞攻击患者身体的风险。
最先进的NK细胞疗法目前正在进行II期临床试验,以治疗实体瘤和血癌。该领域一些最著名的生物技术公司包括美国的Bellicum Pharmaceuticals和NantKwest,以及瑞典的XNK Therapeutics。
去年,围绕NK细胞治疗癌症的欧洲和北美交易有所增加,其中一个主要受益者是荷兰的Kiadis Pharma,就在与赛诺菲达成8.75亿欧元的许可协议几个月后,该公司于去年11月又被赛诺菲收购。
今年在美国已经有了一笔巨额交易:1月28日,NK细胞治疗公司Artiva Biotherapeutics与大型制药公司默沙东展开了价值高达15亿欧元的合作。利用Artiva现货型同种异体NK细胞制造平台及专有的CAR-NK技术,开发针对实体瘤相关抗原的新型CAR-NK细胞疗法。
总的来说,研究人员和投资者显示出了对NK细胞疗法日益增长的热情,这已转化为大量投资。展望未来,该领域公司的主要方向之一是将NK细胞疗法扩展应用到更多类型的肿瘤上。
来源:2021年3月2日生物谷
3、2021年全国两会多位代表委员为干细胞行业发展建言献策
全国人大代表李振国建议,加快推进干细胞技术向成药的转化进度,促进产业高质量快速发展。首先,规范人体组织细胞捐献,建议国家尽快出台中国版《人体细胞组织良好操作规范》(GTP),为未来国家在再生医学等领域实现弯道超车扫清障碍;其次,出台干细胞产品临床准入的伦理考量标准;加强对干细胞工艺和质量体系的技术指导,出台干细胞质量控制体系指南,建议出台伦理考量指导规范,从原始来源,生产工艺,适应症等方面给出判断依据,综合考量伦理风险,指导临床试验/研究;此外,加大资金支持,解决创新药物研发企业在药品上市前的资金问题,考虑在国内有条件的区域开展受试者资助的临床研究,先行先试,降低企业新药研发与转化成本。
全国政协委员陈海佳建议,进一步推进我国干细胞产业高质量发展,加强干细胞科技成果转化与临床研究应用,加快我国从全球干细胞行业跟跑者、并跑者变领跑者,提高国际干细胞领域核心竞争力,抢占国际干细胞行业制高点。在收费方面,我希望权限能够下放到以省为单位的科研平台,比如在细胞制备、临床检测这些方面可以做一些收费,细胞治疗可以免费,这样会更大的提高临床研究进一步转化的热情。
来源:2021年3月4日干细胞
4、有效推动干细胞临床应用在上海先行先试全国政协委员建议优先支持自体、最小操
作对尚无有效治疗手段且临床证明有效的产品进行技术转化
作为生物医药产业、生命科技的前沿领域,细胞疗法在监管方面也在不断探索。目前,美国和欧盟建立了药品单轨制管理模式,日本实行药品和技术的双轨制管理模式。
“我国自2015年以来细胞产业监管体系逐渐规范,但从全链条和全生命周期的监管过程看,还存在较多空白点和拥堵点,影响了产业长足发展。”全国政协委员、浦东新区副区长李国华建议,针对这些问题,要进一步探索开展这一领域监管的集成创新。
他建议,支持上海、浦东聚焦细胞治疗,率先突破,开展全产业链培育和全链条监管的集成创新。
首先需要畅通细胞治疗产品的产业化、商业化路径。建议制定细胞治疗(药品/技术)临床应用的监管暂行办法。研究制定细胞治疗临床应用的收费指南。以CAR-T细胞治疗药物为试点,探索通过信息备案、电子监管、资料留存等方式,多方协作,便利化冷链运输。
其次,需要畅通细胞治疗技术的应用路径。建议,建立干细胞制剂的质量多方认证及审评沟通机制。探索规范干细胞医疗技术的准入标准、审评路径、制备标准和临床应用,优先支持自体、最小操作、对尚无有效治疗手段且临床证明有效的产品进行技术转化,有效推动干细胞医疗技术的临床应用在上海先行先试。
此外,还需畅通细胞治疗技术的探索性创新路径。需要完善IIT研究发起机制,降低IIT发起的资金障碍和风险障碍。依托区域伦理委员会、专家委员会等加强细胞领域科学伦理审查机制建设。畅通细胞药品非技术审评问题的沟通渠道。探索基因治疗临床研究管理办法、审评机制和技术指导原则,推动基因治疗的前沿探索。
来源:2021年3月8日干细胞
5、滤泡性淋巴瘤(FL)首个CAR-T细胞疗法!吉利德Yescarta获美国FDA批准新适应症:总缓解率91%!
近日宣布,美国食品和药物管理局(FDA)已批准CD19 CAR-T细胞疗法Yescarta(axicabtagene ciloleucel)一个新的适应症:用于治疗先前已接受过2种或多种系统疗法的复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。FL是一种常见的惰性非霍奇金淋巴瘤(iNHL),也是全球第二大最常见的淋巴瘤类型。
结果显示,在全部R/R FL患者中(81例可评估患者进行疗效分析),有91%的患者接受Yescarta单次输注表现出治疗反应(ORR=91%),其包60%的患者实现完全缓解(CR=60%)。中位随访14.5个月时,中位DOR尚未达到。在安全性分析数据集中(n=146),3级或更高级别的细胞因子释放综合征(CRS)和神经系统毒性发生率分别为8%和12%。
Yescarta于2017年10月获FDA批准,是第一个治疗复发或难治性大B细胞淋巴瘤(LBLC)成人患者的CAR-T细胞疗法,具体适应症为:用于既往接受过2种或多种系统疗法的复发或难治性LBCL成人患者的治疗,包括弥漫性大B细胞淋巴瘤(DLBCL)、原发性纵膈大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤(HGBL),以及源于滤泡性淋巴瘤(FL)的DLBCL(即转化型FL,TFL)。Yescarta不适用于原发性中枢神经系统淋巴瘤的治疗。
来源:2021年3月8日生物谷
6、新加坡首个商业化CAR-T疗法!诺华Kymriah获批:治疗2种B细胞恶性肿瘤
近日宣布,根据新的细胞、组织和基因治疗产品(CTGTP)监管框架,新加坡健康科学管理局(HSA)已批准Kymriah(tisagenlecleucel),作为新加坡首个商业化的嵌合抗原受体T细胞(CAR-T)疗法。
Kymriah是一种CD19导向的基因修饰自体T细胞免疫细胞疗法,被批准用于治疗2种致命的癌症,这2种癌症的治疗方案有限且预后历来较差,此次批准解决了这些患者对新疗法的迫切需求。Kymriah的原理是将患者的T细胞进行基因修饰表达一种旨在靶向抗原CD19的嵌合抗原受体(CAR),CD19是一种表达于多种血液肿瘤细胞表面的抗原蛋白,包括B细胞淋巴瘤和白血病细胞。
HSA批准Kymriah:(1)用于治疗2至25岁患有难治性、移植后复发、第二次或多次复发的B细胞急性淋巴细胞白血病(ALL)儿童和年轻成人患者;(2)用于治疗接受2种或多种系统疗法后的复发或难治性(r/r)弥漫性大B细胞淋巴瘤(DLBCL)成人患者。
新加坡总医院(SGH)是东南亚首家投入运营的Kymriah治疗中心,用于治疗成人r/r DLBCL和年轻成人r/r B细胞ALL患者。诺华目前正在与新加坡国立大学医院(NUH)讨论,以扩大成人r/r DLBCL和儿童及年轻成人r/r B细胞ALL患者使用Kymriah的可能性。
新加坡国立癌症中心医学主任William Hwang教授表示:“CAR-T疗法是免疫治疗策略方面的一个重大进展,是个体化癌症治疗的一个重要进步。这种疗法作为一种挽救生命的疗法显示出巨大的前景,并为血液癌症患者带来了新的希望。”
来源:2021年3月11日生物谷
7、干细胞疗法治疗1型糖尿病!美国FDA授予干细胞衍生的完全分化胰岛细胞疗法VX-880快速通道资格!
美国食品和药物管理局(FDA)已授予在研细胞疗法VX-880快速通道资格(FTD),VX-880是一种干细胞衍生的、完全分化的胰岛细胞疗法,用于治疗1型糖尿病(T1D)。
快速通道资格(FTD)旨在加速针对严重疾病的药物开发和快速审查,以解决关键领域严重未获满足的医疗需求。实验性药物获得快速通道资格,意味着药企在研发阶段可以与FDA进行更频繁的互动,在提交上市申请后如果符合相关标准则有资格进行加速审批和优先审查,此外也有资格进行滚动审查。
值得一提的是,VX-880是第一个利用完全分化的、产生胰岛素的胰岛细胞治疗1型糖尿病的干细胞衍生疗法。另外,VX-880是已知的第一个也是唯一一个被授予快速通道资格(FTD)的胰岛替代疗法。VX-800用于替代1型糖尿病患者中被破坏的胰岛细胞,有潜力对1型糖尿病患者产生有意义的影响。
1型糖尿病(T1D)是由于胰腺中产生胰岛素的胰岛细胞的自身免疫破坏,导致胰岛素分泌减少和血糖控制受损。缺乏胰岛素会导致身体对营养物质的处理异常,从而导致高血糖水平。高血糖会导致糖尿病酮症酸中毒,随着时间的推移,会导致并发症,如肾病/衰竭、眼病(包括视力丧失)、心脏病、中风、神经损伤甚至死亡。由于胰岛素输送系统的局限性和复杂性,T1D患者的血糖控制很难达到和维持平衡。低血糖仍然是血糖管理的一个关键限制因素,严重低血糖可导致意识丧失、昏迷、癫痫发作、受伤,甚至致命。目前除了胰岛素治疗外,治疗T1D的选择有限。
VX-880(原名STx-02)是一种研究性异基因人干细胞衍生胰岛细胞疗法,目前正计划对低血糖意识受损和严重低血糖的T1D患者进行评估。VX-880有潜力通过恢复胰岛细胞功能(包括胰岛素的产生)来恢复机体调节血糖水平的能力。
来源:2021年3月12日生物谷
8、间充质干细胞来源的小细胞外囊泡促进小鼠和非人类灵长类心肌梗死后的血管生成
文章揭示了间充质干细胞(mesenchymal stem cells, MSCs)来源的sEV通过内容物miR-486-5p促进小鼠和非人类灵长类动物MI后的血管生成(angiogenesis),从而保护梗死心脏的心功能。
越来越多的证据表明,干细胞疗法可能是改善血管生成的一种有前途的方法,而sEV也已被认定为干细胞发挥诱导血管生成功能的主要媒介2。sEV可以携带多种因子,包括可溶性蛋白、mRNA、microRNAs和长链非编码RNA,它们可以转移到受体细胞中并触发下游信号通路。但是,sEV介导血管生成的具体机制仍未完全阐明。
进一步作者发现抑制miR-486-5p可以减弱HP-sEV的治疗效果,相反,上调miR-486-5p可以增强N-sEV的治疗效果,表明sEV来源的miR-486-5p的确可以发挥改善心肌功能的治疗效果。
重要的是,在非人类灵长类动物(nonhuman primate, NHP) MI模型中,外源表达miR-486-5p的N-sEV可促进血管生成和心脏恢复,且不会增加心律不齐的并发症。
总的来说,这些数据表明在NHPs心肌梗死后的心脏注射miR-486-5p工程sEV是可行和安全的,该研究为进一步研究工程化sEV对心肌的长期影响提供了依据。
来源:2021年3月12日生物谷
9、细胞产业先行先试!近期深圳、昆明细胞治疗产业政策再有新动作
深圳:3月12日下午,为贯彻落实《深圳建设中国特色社会主义先行示范区综合改革试点实施方案(2020—2025年)》赋予深圳在生物医药领域更大改革自主权、加强立法探索的战略决策部署,推进《深圳经济特区细胞和基因产业促进条例》(以下简称《条例》)的制定工作,市人大常委会召开立法征求意见座谈会。市人大常委会党组书记、主任骆文智主持会议,市人大常委会副主任蒋宇扬、贺海涛参加会议。
骆文智指出,我市生物医药产业起步早、增长快,但同比北京、上海、江苏泰州等城市,企业规模及产值明显偏小,产业发展存在短板。扎实做好《条例》起草工作,一是要解放思想,先行先试,发挥立法引领推动保障作用,做到在不与国家法律基本原则相冲突的前提下,用好经济特区立法权和国家授予的改革试点权,理念思路、政策举措要有所突破;二是依托企业,做好服务,发展细胞和基因产业,财政及相关产业主管部门要着力支持企业不断加大研发创新力度,加快重点领域关键技术突破,以产品质量的提升,实现产业高质量发展;三是政府部门要加强配合,以大局为重,积极参与《条例》起草工作,《条例》涉及国家各部委多方面政策法规,五个起草领导小组成员单位必须负责起草相关条款,把法条写实、写好。
昆明:3月11日,昆明国家高新技术产业开发区(以下简称“昆明高新区”)细胞产业政策发布会暨昆明高新区细胞产业联盟挂牌仪式举行,会议还发布了《昆明高新区促进细胞产业集群创新发展若干政策(试行)》围绕支持细胞产业集群发展、促进细胞产业标准化建设、扶持细胞产业平台建设等七个方面出台了16条政策措施,政策要点是以昆明高新区细胞产业集群创新园为核心区和主要聚集区,着力推动细胞产业集群发展。
为支持成立细胞产业联盟,支持细胞产业联盟创新发展,昆明高新区管委会每年安排专项资金,对制订并成为云南省细胞产业地方标准的企业,给予企业每项标准50万元的一次性奖励;对获得美国血库协会(AABB)、中国细胞制备标准认证部门、中国合格评定国家认可委员会(CNAS)等国内外细胞相关项目认证的企业,分别给予企业100万元的一次性奖励。
此外,获得国内外细胞技术相关重点实验室、企业技术中心、工程研究中心、科创中心认证的企业,按照国家级、省级和市级分别给予其100万元、80万元、50万元的一次性科研经费补助。除此之外,与细胞科技企业签订三年及以上劳动合同的新引进细胞生物学专业博士学位以上人才,三年内每年给予其2万元的租房或生活补贴,其上缴的个人所得税三年内全额返还。为推进细胞科技成果转化,昆明高新区管委会对完成临床前研究,获得临床批件或默示许可或允许按医疗技术开展临床研究的细胞科技项目,每个项目奖励200万元。
下一步,昆明高新区将紧紧抓住市委、市政府布局细胞产业的重大机遇,发挥昆明高新区率先发展细胞产业的领跑优势,利用市区政策共同发力的叠加优势,在已经聚集的20余家细胞科技企业的基础上,加大招商引资和产业扶持力度,将细胞产业作为推动昆明高新区产业升级新的爆发点,努力打造西南地区领先的生命科技产业新高地。
来源:2021年3月16日干细胞
10、重磅!国家卫健委明确干细胞临床应用将依据《生物医学新技术临床研究和转化应用管理条例》进行管理!
近日,国家卫健委官网刊登了《对十三届全国人大三次会议第7606号建议的答复》。
答复函中明确提出:下一步,国务院即将出台《生物医学新技术临床研究和转化应用管理条例》,干细胞技术临床研究和转化应用将依据该条例的有关规定进行管理。
http://www.nhc.gov.cn/wjw/jiany/202102/2ff25eb741584a0284767935c67333f8.shtml
来源:2021年3月16日干细胞
11、最新发布!河北省正式发布《细胞免疫治疗临床操作技术规范》

近日,河北省市场监督管理局组织制定了《细胞免疫治疗临床操作技术规范》。本文件规定了相关术语与定义、基本要求、风险预案、实施方案的制定、实施与操作、毒副反应的处理、患者随访等内容。本文件适用于实施细胞免疫治疗的医疗机构与细胞制备机构。该规范文件于2021年2月21日实施。
https://new.qq.com/omn/20210324/20210324A08G1B00.html
来源:2021年3月19日干细胞
12、我国发布《人间充质干细胞》等6项干细胞团体标准,颁出首张生物样本库认可证书!

旨在推动中国干细胞领域健康发展、促进生命健康领域科技创新的第二届国家干细胞资源库创新联盟大会暨标准发布会,20日在北京怀柔举行。
会上,中国科学院动物研究所国家干细胞资源库获中国合格评定国家认可委员会颁发中国第一张生物样本库认可证书,中国细胞生物学会标准工作委员会发布了6项干细胞领域团体标准。
获颁中国首张生物样本库认可证书的国家干细胞资源库,既成为中国首家获得ISO 20387认可的生物样本库,也是国际首家获得认可的干细胞资源库,标志着中国生物样本库的认可制度建设已走在世界前列。通过该项认可制度,将更好推动中国生物样本库建设的规范化和标准化,确保生物样本质量,推进国际交流合作与共享,为人类保存和利用好珍贵的遗传资源奠定基础。
当天最新发布的6项干细胞团体标准包括《人间充质干细胞》《人视网膜色素上皮细胞》《人诱导多能干细胞》《人心肌细胞》《人造血干/祖细胞》《原代人肝细胞》,对相应的细胞生物学特性、关键质量属性、生产工艺、生产过程和质量控制、检验方法及规则、包装与标签、储存运输等方面进行系统规定,将有力促进干细胞产业发展。
https://m.chinanews.com/wap/detail/chs/zw/9436811.shtml
来源:2021年3月20日中国新闻网
13、 肾细胞癌(RCC)靶向新药!口服下一代VEGF-TKI Fotivda上市:疗效击败拜耳Nexavar(多吉美)!
靶向抗癌药Fotivda(tivozanib),是一种口服、下一代血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI),于2021年3月10日获得美国FDA批准:用于治疗接受过2种或2种以上系统治疗方案的复发性或难治性肾细胞癌(RCC)成人患者(第一个被批准)。
该药将为这类患者提供了一个重要的治疗选择。用药方面,Fotivda的推荐剂量为1.34毫克,每天口服一次,可与或不与食物同服,每28天一个周期中,服药21天、停药7天,直到疾病进展或出现不可接受的毒性。
Fotivda的批准是基于关键III期临床研究TIVO-3的结果。TIVO-3是一项随机、阳性对照、多中心、开放标签研究,在351例高度难治性晚期或转移性RCC患者中开展,评估了Fotivda相对于拜耳靶向抗癌药Nexavar(多吉美,通用名:sorafenib,索拉非尼)的疗效和安全性。结果显示:(1)与Nexavar治疗组相比,Fotivda治疗组中位无进展生存期(PFS)延长44%(5.6个月 vs 3.9个月)、疾病进展或死亡风险降低26%(HR=0.74,p=0.016)。在既往接受和没有接受免疫检查点抑制剂治疗患者中,Fotivda的PFS均较Nexavar延长。(2)Fotivda治疗组的中位OS为16.4个月、Nexavar治疗组为19.2个月(HR=0.97,95%CI:0.75-1.24)。(3)Fotivda治疗组ORR为18%,Nexavar治疗组为8%(p=0.02)。
该研究中,最常见(≥20%)的不良反应是疲劳、高血压、腹泻、食欲减退、恶心、发音困难、甲状腺功能减退、咳嗽和口腔炎。最常见的3级或4级实验室异常(≥5%)是钠减少、脂肪酶增加和磷酸盐减少。
来源:2021年3月23日生物谷
14、CD19 CAR-T细胞疗法!百时美Breyanzi(liso-cel)日本获批:治疗大B细胞淋巴瘤和滤泡性淋巴瘤!
日本厚生劳动省(MHLW)已批准Breyanzi(lisocabtagene maraleucel,liso-cel),这是一款CD19导向、嵌合抗原受体(CAR)T细胞疗法,用于治疗:(1)复发或难治性大B细胞淋巴瘤(R/R LBCL)患者;(2)复发或难治性滤泡性淋巴瘤(R/R FL)患者。不适用于原发性中枢神经系统(CNS)淋巴瘤患者的治疗。
Breyanzi则是全球获批上市的第4款CD19导向CAR-T细胞疗法,之前已上市的3款CD19 CAR-T细胞疗法分别为:诺华Kymriah(tisagenlecleucel)、吉利德科学Yescarta(axicabtagene ciloleucel)和Tecartus(brexucabtagene autoleucel)。
Breyanzi是一种自体、CD19导向、CAR-T细胞疗法,具有明确的组成和4-1BB共刺激域。Breyanzi由纯化的CD8+和CD4+T细胞以特定比例(1:1)组成,4-1BB信号增强了Breyanzi的扩增和持久性。Breyanzi提供了一种潜在的治愈性疗法,单剂量Breyanzi含有50-100 x 10的6次方个CAR阳性活T细胞。
目前,Breyanzi的营销授权申请(MAA)也正在接受欧洲药品管理局(EMA)的审查。此前,EMA已授予Breyanzi治疗R/R DLBCL的优先药物资格(PRIME)。
来源:2021年3月28日生物谷
15、细胞治疗政策动向!浙江自贸区杭州萧山片区将重点争取对细胞治疗和基因治疗临床和商业化审批权限的开放
近日,杭州市萧山区人民政府在官网上正式发布《中国(浙江)自由贸易试验区杭州片区萧山区块建设方案》。
方案中明确提出:探索生物医药先行先试。推动在生物医药审评审批、进出口通关、医疗服务、数据和人才要素保障等方面的先行先试。重点争取对细胞治疗和基因治疗临床和商业化审批权限的开放,探索建立细胞与基因治疗药物申报、检测过程中的绿色通道。支持应用于临床研究的境外创新医疗技术准入,试点设立外资举办医疗机构、健康医疗保险机构、健康管理机构等境外专业机构。
http://www.xiaoshan.gov.cn/art/2021/2/25/art_1229293108_1721045.html
近日,杭州发改委、科技局、卫健委、市场监督管理局联合印发《杭州区域细胞制备中心试点管理办法(试行)》。
http://www.hangzhou.gov.cn/art/2021/3/11/art_1229063383_1721605.html
