发布时间:2021-03-30 浏览量:0
小编有话说
“韶华逝,华发生”,岁月的车轮无情地推动着人类“生老病死”这貌似“坚不可摧”的定律,真可谓岁月朝朝,“衰”不容情啊。衰老面前,真的毫无“情面”可讲吗?在科学技术如此进步的今天,有没有什么先进的技术可以打破这“无情”的定论?“长生不老”可否运用现代技术实现呢?今天,小编就跟大家聊一聊(叨叨一下)抗衰这个话题。

第1则
-THE FIRST-
“衰老”这个词可能比你了解的更复杂些
提到衰老,人们往往会想到老年人的专利:满头白发、记忆力减退、动作迟缓等。大家了解到的衰老,更多的是一种现象。而真正的衰老呢,是一种动态表现,参与机体癌症以及疾病发生的调节机制。你能看到的衰老,只不过是机体细胞衰老的一种表现而已。衰老不仅仅与年龄、时间相关,更重要的是,它与人体健康息息相关。这么复杂的“衰老”,我们还是好好认识一下吧!
第2则
-THE SECOND-
人人都知道,可能又不太清楚地“衰老”
正常机体内,细胞的应激反应可以激活衰老,产生衰老细胞,这个过程发生在整个生命过程中,所以,真正意义上的衰老指的是细胞衰老。
细胞衰老在胚胎发生、伤口愈合、宿主免疫和肿瘤抑制等多种生理和病理过程中起着有益的作用,已经成为癌症生物学和衰老研究的科学基础。
细胞衰老可以分为急性衰老,比如防止创伤部位过渡纤维化;慢性衰老,比如机体应激反应造成的持久性的大分子损伤(蛋白错误折叠、DNA损伤、表观遗传改变、端粒缩短等等);治疗性衰老,比如放、化疗引起的正常细胞损伤导致的机体应激反应。
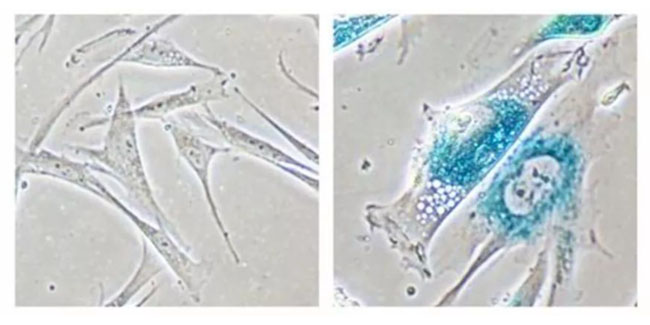
左:SA-β-gal染色正常细胞 右:SA-β-gal染色衰老细胞
不同形式造成的细胞衰老呢,总有着相似的核心特征,比如:细胞生长受到阻滞、抵抗增殖相关信号蛋白的表达(p16INK4a)、损伤感知信号通路的激活(p38MAPK、NF-kB)而导致衰老转录本表达、衰老相关β-半乳糖苷酶(SA-β-gal)活性的增强、衰老相关细胞表型(SASP)表达、DNA损伤等等。
细胞衰老死亡与新生细胞生长更替是新陈代谢的必然规律,这种动态平衡维持机体功能的发挥。每种细胞都有固有的更新时长,如成熟粒细胞的寿命约10几个小时,胃肠道上皮细胞每周更新1次,皮肤表皮细胞更新需要1~2个月,而红细胞约为4个月。

From 参考文献【2】
但是,随着年龄的增长,各种细胞活力下降,打破了固有平衡:衰老细胞开始稳定积累。非增殖性的衰老细胞增多,占据了健康细胞增殖的公共资源——细胞微环境,并且产生促炎性细胞因子,导致衰老相关疾病的发生与发展。
■ 说人话版
衰老是一种机体起保护作用的防御机制。细胞衰老就是细胞在结构和功能上发生了改变,使得细胞不能正常增殖、代谢,这是很自然的生理现象。问题是,无法行使正常功能的细胞越来越多的话,就会“鸠占鹊巢”,影响了新细胞的产生,还会造成机体局部炎症,导致疾病发生。
第3则
-THE THIRD-
衰老与人体健康
凡事都有利有弊,衰老在人类健康与疾病中的作用,将这对“辩证兄弟”演绎得淋漓尽致,真是剪不断,理还乱。但是科学家们还是努力在帮我们理这条线,正所谓“路漫漫其修远兮”,抗衰之路等了千年了,也不在乎再等等吧。首先,看看衰老机制对我们机体有意的作用吧。
抵抗癌症
细胞衰老作为细胞内在机制,可以防止肿瘤转化。但是就像前面所说的,细胞衰老又可以释放炎性因子,而慢性炎症又可以诱导癌症的发生。真是复杂的“双刃剑”啊!
全基因组分析表明,p16INK4a和/或p53功能的丧失是人类癌症中常见的遗传事件,而以上两种蛋白功能的丧失或多或少都伴随着衰老的破坏。p53是一种能启动凋亡或者衰老的蛋白,其预防癌症的能力主要取决于衰老的诱导。
助力宿主免疫
衰老对细胞免疫和天然免疫都起着复杂的作用。举个简单例子,衰老细胞可以招募天然免疫细胞,这可能会阻止病毒感染的进一步传播。为了破坏衰老机制,某些病毒产生癌蛋白(如E6/7[人乳头瘤病毒]、E1A/B[腺病毒]和大T抗原[多瘤病毒]),抑制RB和/或p53通路。
因此,衰老被认为是对付某些类型感染(例如,通过限制宿主细胞增殖)的直接屏障,并作为激活先天免疫的一种手段。但值得注意的是,这一过程可能会损害细胞免疫导致衰老或慢性感染。
瞧瞧,衰老就是这么的“不单纯”,总是化简单为繁复。
创伤修复
在各种损伤动物模型中,可以观察到p16INK4a快速而强有力地表达(这个蛋白不陌生哈,前面提到了它也是抵抗增殖相关蛋白),以及与衰老相关的NF-kB信号通路的激活和SASP细胞因子的表达。
科学家们发现,清除p16INK4a表达的细胞,会延迟伤口的愈合,经过深入研究发现:p16 INk4a 表达的细胞,可以定位于损伤部位,通过炎症因子释放招募巨噬细胞。这种通过SASP细胞因子招募巨噬细胞的能力,很可能是衰老细胞在伤口愈合中的作用机制之一。
See?衰老又是一把“双刃剑”。
■ 说人话版
衰老人体内自然代谢的生理现象,通过衰老机制的调节,有利于抵抗细胞癌变,激活先天免疫,就连伤口愈合中,它也有有利的一面。But!人类不可能跟衰老做朋友,总的来说,衰老带来的正面作用,总是带有“负面情绪”的。
第4则
-THE FOURTH-
衰老与人体疾病
这么看来,衰老也不是这么一无是处,但是聪明的人类还是看穿了它“碟中谍”的身份——没错!让人头痛的“老年病”,也是因为它!
动脉粥样硬化
对于老年人来讲,动脉粥样硬化(AS)可以引起很多疾病,比如高血压、缺血、心肌梗死等等。
很多人将饮食不健康、作息不规律归因为AS的诱因,但其实你细品:有些作息规律,看着健硕、瘦瘦的老年人,也会得这个病呀!这又得怪衰老细胞了。经过研究发现,衰老细胞的积累也有助于AS的发生。研究指出,衰老造成的线粒体功能下降以及SASP中IL-6的血管内积累,可以独立于慢性高脂血症,加速AS的发生。这也就是为什么看着不太胖的老年人也会得AS了。
II型糖尿病
我们都知道,II型糖尿病有一个诱因就是β-胰岛细胞缺失或者功能不健全。
一方面,当人们长期处于慢性炎症侵蚀或者高脂进食状态下,可导致胰岛素抵抗,累及胰腺产生更多的胰岛素用以维持血糖平衡,而过渡增殖的β-细胞因端粒磨损造成衰老,无法适应胰岛素抵抗,使人容易患II型糖尿病;另一方面,衰老细胞可以引起胰岛β-细胞增殖受阻,如果胰岛细胞不能及时得到补充,会加速糖尿病的进程;再者,衰老导致脂肪细胞激活p53-p21信号通路激活,产生胰岛素抵抗,进一步加速了II型糖尿病的进程,又加速了β-细胞的损失,最终导致功能性损伤。
所以,衰老可以通过对β细胞的影响以及对组织胰岛素抵抗的影响来调节糖尿病的易感性。
骨关节炎
骨关节炎(OA)的主要特征是软骨分解以及代谢信号失衡导致关节基质遭到破坏。
衰老细胞导致的氧化应激,造成软骨母细胞中抗氧化体系的代谢失衡,细胞内活性氧类物质浓度升高,对关节软骨母细胞的再生能力造成损伤,无法实现软骨再生;同时衰老的软骨母细胞释放更多的炎性因子,造成局部炎症环境加剧,破坏细胞外基质稳定性;衰老软骨母细胞分泌蛋白聚糖能力下降,且改变其组分,影响细胞外基质的生物学组成,造成局部组织功能紊乱,加速OA的进程。
虚弱(大部分人比较用不上)
对癌症的治疗中,化疗结束后,虚弱(疲劳)是一种持久的副作用表现。有研究表示,化疗导致的DNA损伤,会使机体产生过多的衰老细胞。在小鼠模型中,如果清除化药导致的衰老细胞,可以有效改善化疗后的多种副作用。另外,在乳腺癌妇女的化疗中,化疗前病患外周血中衰老相关标记较高的话,会比同样治疗方式下衰老相关标记少的妇女,更容易产生化疗后的虚弱等副作用。
■ 说人话版
衰老一般可以通过增强抑制增殖性蛋白的表达,帮助人类对抗癌症,甚至在损伤修复中也可以起到一定的积极意义,还可以帮助炎症部位招募巨噬细胞,促进损伤修复;但是凡事都有利弊,衰老细胞的过渡积累,可以导致甚至加速许多疾病的进程,诸如:动脉粥样硬化、II型糖尿病、OA、化疗引起的副作用等等。
第5则
-THE FIFTH-
人类怎样抵抗衰老?
人类对衰老的研究,使人们不再仅仅局限于针对时间或者年龄来处理衰老相关的医学事件。
目前,体内累积的高丰度衰老细胞可以作为潜在的分子治疗靶点,这为抗衰提出了一个可行性方案,同时也是一种机制的提出:衰老细胞清除可能减轻衰老相关疾病的发生。大多数已报道的衰老干预措施分为两类,一是通过调节代谢途径来清除衰老细胞,如基于β-半乳糖苷酶开发新前体药物;二是通过外源性补充参与基因修复、能量代谢等生理活动的关键分子,如补充β-烟酰胺单核苷酸。例如:在一项小鼠动物的实验中显示,清除衰老细胞可以使这些动物寿命延长20–30%。

2016年,国际学术期刊《科学》杂志(Science)将“清除衰老细胞使机体保持年轻”评选为年度十大科学突破之一。那么,目前关于衰老机制的认识,都有哪些假说呢(干细胞衰竭、线粒体损伤、端粒假说等等)?科学家又是如何通过这些假说逐步对抗机体衰老,提出潜在延年益寿的方法呢?下一期,跟大家继续聊聊抗衰这个话题。
参考文献
[1] R.J. Pignolo, J.F. Passos, S. Khosla, et al., Reducing Senescent Cell Burden in Aging and Disease. Trends Mol Med, 2020. 26(7): 630-638.
[2]S. He and N.E.J.C. Sharpless, Senescence in Health and Disease. 2017. 169(6): 1000-1011.
[3]I. Martinez, V. Garcia-Carpizo, T. Guijarro, et al., Induction of DNA double-strand breaks and cellular senescence by human respiratory syncytial virus. Virulence, 2016. 7(4): 427-42.
[4]B.M. Hall, V. Balan, A.S. Gleiberman, et al., Aging of mice is associated with p16(Ink4a)- and β-galactosidase-positive macrophage accumulation that can be induced in young mice by senescent cells. 2016. 8(7).
[5]B.G. Childs, M. Durik, D.J. Baker, et al., Cellular senescence in aging and age-related disease: from mechanisms to therapy. Nat Med, 2015. 21(12): 1424-35.
[6]J. Campisi, Aging, cellular senescence, and cancer. Annu Rev Physiol, 2013. 75: 685-705.
[7]S.X. Leng, Q.L. Xue, J. Tian, et al., Inflammation and frailty in older women. J Am Geriatr Soc, 2007. 55(6): 864-71.
[8]J. Krishnamurthy, C. Torrice, M.R. Ramsey, et al., Ink4a/Arf expression is a biomarker of aging. 2004. 114(9): 1299-1307.