发布时间:2021-08-31 浏览量:0

“韶华逝,华发生”,岁月的车轮无情地推动着人类“生老病死”这貌似“坚不可摧”的定律!那么在科学技术如此进步的今天,有没有什么先进的技术可以打破这“无情”的定论?“长生不老”可否运用现代技术实现呢?抗衰之三,开篇。
在诱发衰老的众多假说中呢,线粒体功能障碍学说受到很多学者的认可。那么,线粒体是如何参与衰老的?以及如何理解这些机制,从而引入一个线粒体靶向疗法的新时代,用以潜在地减缓或逆转衰老过程?今天呢,小编就从线粒体聊起吧。

线粒体与衰老的渊源
越来越多的证据表明,线粒体功能异常与衰老之间存在动态关系。衰老细胞的特征是线粒体质量、膜电位和线粒体形态的变化,而这部分功能失调的线粒体会随着年龄的增长而积累。线粒体糖蛋白(这是一组进化保守的蛋白质,调节不同物种的衰老)的耗尽,以及对线粒体功能的选择性化学抑制,触发的衰老称作线粒体功能相关衰老(mitochondrial dysfunction-associated senescence,MiDAS)。
SIRTs是一个调节从酵母到哺乳动物衰老的蛋白质家族,Wiley[1]等人指出,敲低SIRT3或SIRT5后,可引起MiDAS;另外,用溴化乙钠或电子传输链抑制剂罗替诺酮造成线粒体损伤及功能障碍,也会导致MiDAS。以上实验证明了线粒体功能障碍确实可引发衰老。然而,MiDAS并不是由之前认为的核DNA损伤的积累或氧化应激引起的。MiDAS有一个特定的分泌体,能够驱动一些衰老的表型,如NAD+/NADH比率的降低,进而导致P53激活,而P53激活可以抑制SASP,所以MiDAS与应激诱导的衰老存在差异,这将有别于以往基于SASP的抗衰治疗策略。
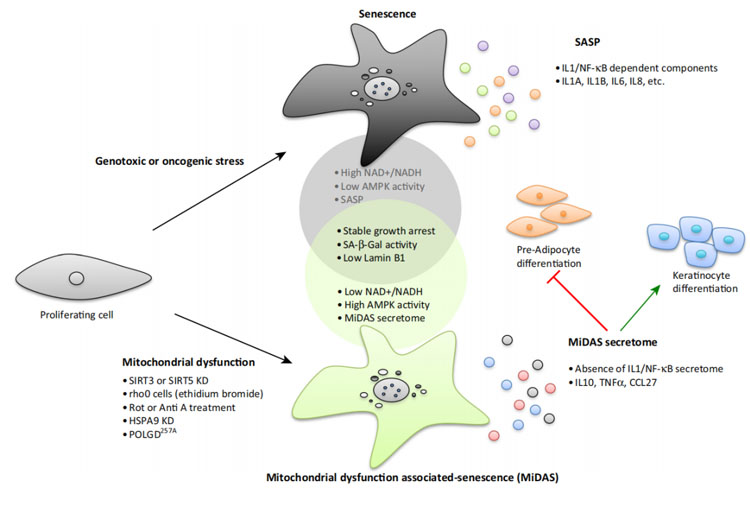
图1:线粒体功能障碍相关衰老(MiDAS)与应激诱导衰老的比较[2]。
线粒体核电站不止提供能量
线粒体是大多数真核细胞中非常重要的一个亚细胞器,长得像蚕蛹一般(图2)。它之所以重要是因为它是一个能量站,负责把营养转变成能量供应给身体各个器官,保证身体正常运转。所以,人们经常把线粒体比喻成“核电站”。然而,要想了解线粒体在衰老中扮演的角色,就不能单单将它作为简单的供能单位。ATP(三磷酸腺苷)是人体最直接的供能物质,线粒体通过燃烧糖类、脂类和氨基酸来实现ATP的制造。
图片2:线粒体的形态,来自网络
线粒体除了合成ATP外,还有极为重要的功能:譬如产生超氧阴离子(O2-)等活性氧(ROS)、调节氧化还原电势、细胞氧化还原信号传导、调控细胞凋亡和基因表达。什么意思?线粒体功能的发挥,与机体氧化还原、细胞调控、基因表达等方方面面是交织在一起的。线粒体不能再被视为简单的生物能量学工厂,而是作为细胞内信号传导、先天免疫调节器和干细胞活性调节器的平台。线粒体作为干细胞功能的调节剂,就印证了这一观点。
成人干细胞功能的下降也是诱导细胞衰老的重要原因。以造血干细胞(HSCs)为例,有这样一种理论:静止的HSCs通常被认为依赖于糖酵解代谢作为其ATP的主要来源,而不是主要依靠线粒体。根据这一理论,线粒体在这些细胞的静息生物能量特征中起着相对较小的作用。静止的HSCs用这种供能方式,可以尽量减少线粒体ROS产生的长期有害影响。那么,线粒体是否在干细胞中是可有可无的呢?
答案肯定是否定的。越来越多的例子表明,ROS在干细胞生物学中发挥着积极的和必要的信号传导作用。对mtDNA突变小鼠的分析,我们渐渐看到了线粒体和干细胞之间的联系。POLG敲除小鼠模型中,线粒体功能发生障碍,引发干细胞缺陷,从而导致小鼠出现严重且致命的贫血以及B细胞异常[3],类似现象也发现在神经干细胞群体中。以上干细胞缺陷的产生,是由于线粒体功能障碍引起的。因此,即使干细胞似乎并不依赖氧化磷酸化来获得其能量,线粒体依然是这些细胞及其祖细胞实现长期、稳定功能运转所必需的。

核泄漏后遗症——炎性衰老
ROS在氧化还原信号传导中发挥重要作用,在生理水平上维持细胞的基本功能。正常细胞一生中都可以产生ROS,生理状态下,线粒体呼吸链是ROS的主要来源,一般不多于总耗氧的5% 用来产生ROS。当胞内氧化产物过高时,细胞可以通过清除多余的ROS来避免氧化应激损伤。当线粒体功能发生障碍时,会导致氧化产物持续积累。过多的氧化应激可以促使体内促炎表型的累积,增加与年龄相关慢性疾病的发生风险。目前,氧化应激反应能力已被确定为衰老和长寿的重要决定因素,并涉及许多人类疾病,包括癌症、动脉粥样硬化和相关的心血管疾病、呼吸系统疾病和神经系统疾病。

图3:来自网络
慢性炎症与衰老之间的关系可以描述为炎性衰老:持续的、低级的、无菌的慢性炎症状态,也是衰老的典型标志。炎性衰老以循环炎症标志物,如 IL-6、C-反应蛋白的增加为特征,同时这也是老年人发病率和死亡率增加的危险因素。线粒体膜的年龄依赖性破裂可能会导致线粒体DNA(mtDNA)逃逸,助长与衰老相关的慢性无菌炎症。所以,人类想要借助线粒体功能而发挥抗衰的功效,就要保证线粒体的质量(年轻的、有功能的、没有核泄漏的),在这一点上,干细胞就利用的相当到位。

线粒体抗衰策略之保质
即使线粒体不搞“核泄漏”了,稳稳当当地过日子,终究还是要“老去的”,所以,线粒体想要发挥好抗衰功能,也是要吃“青春饭”的。干细胞具有独特的机制,可以防止老化的或者功能失调的线粒体大量累积。有初步证据显示,在大脑中富含神经干细胞的区域,线粒体自噬现象比较频繁。线粒体自噬的目的,是帮助大脑清除功能失调或者多余的线粒体,从而微调线粒体数和保持能量代谢;永生化上皮细胞培养过程中,对其中干细胞样细胞的研究发现,干细胞中可能还存在一种机制:年轻的与老旧的线粒体可能会不均匀的分布到子代细胞中。这一发现同时也证明了,获得较多年轻线粒体的细胞,能更好的帮助这种干细胞样的上皮细胞维持其干性。目前,这种特征只在体外实验中存在,尚不知体内以及其他细胞中是否存在同样机制,但这为我们的抗衰之路提供了方向,即如何通过调节线粒体功能,达到逆转衰老的作用。

图4:来自网络
SIRT3发现于线粒体中,以NAD依赖的方式调节线粒体乙酰酶组[4]。有趣的是,在老化的HSCs中提高SIRT3或SIRT7水平可以改善老化的干细胞功能,提高它们的再生能力。连接干细胞和线粒体的另一组重要的代谢产物是NAD+/NADH比率。NAD+是人体内一种重要的辅酶,在保健品界也刮起过一阵旋风。如果你对它还比较陌生的话,可能你对NAD+的前体,NMN比较熟悉。2013年,有研究称在年老小鼠和秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)中发现NAD+的水平降低,并导致蠕虫寿命的缩短;还有研究指出NAD+水平随着年龄的增长而下降,对神经干细胞(NSCs)的分析表明,降低NAD+的水平可以诱发干细胞衰老表型的表达,而NAD+的补充可以恢复老NSCs的功能[5]。
基于以上理论,近年来以其前体NMN补充剂作为一种长寿保健品被商业化炒作,日益受到追捧。不得不提的是,NAD+的抗衰老作用只停留在实验室研究层面,这是否仅仅单靠补充单一的NAD+就能实现机体抗衰的作用,还需要科学家们的进一步深入研究以及更多的临床试验来验证。

参考文献:
[1] Wiley, C.D., et al., Mitochondrial Dysfunction Induces Senescence with a Distinct Secretory Phenotype. Cell Metab, 2016. 23(2): p. 303-14.
[2] Gallage, S. and J. Gil, Mitochondrial Dysfunction Meets Senescence. Trends Biochem Sci, 2016. 41(3): p. 207-209.
[3] Chen, M.L., et al., Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood, 2009. 114(19): p. 4045-53.
[4] Lombard, D.B., et al., Mammalian Sir2 homolog SIRT3 regulates global mitochondrial lysine acetylation. Mol Cell Biol, 2007. 27(24): p. 8807-14.
[5] Stein, L.R. and S. Imai, Specific ablation of Nampt in adult neural stem cells recapitulates their functional defects during aging. EMBO J, 2014. 33(12): p. 1321-40.