发布时间:2021-11-16 浏览量:0

疾病背景
急性肺损伤 (acute lung injury,ALI) 被定义为急性和持续性肺部炎症合并血管通透性增加的综合征,其主要特征是肺部大量炎性细胞浸润,炎症细胞产生促炎因子,损伤肺泡上皮细胞和毛细血管内皮细胞,导致肺间质和肺泡水肿,引起呼吸功能障碍,最终发生急性呼吸窘迫综合征,临床表现为进行性呼吸困难和顽固性低氧血症。
目前为止,ALl的临床治疗策略主要有呼吸支持、感染预防、严格控制液体输入,此外肺保护性药物的应用也有助于患者的恢复,例如吸入肺泡表面活性物质、N0、糖皮质激素、抗氧化剂等手段,但疗效依然十分有限。目前ALI的死亡率依然很高(轻度为34.9%,中度为40.3%,严重为46.1%)[1],对新治疗策略的需求依然十分迫切。
间充质干细胞源外泌体治疗肺损伤
外泌体定义
根据国际细胞外囊泡学会的定义,外泌体是细胞外囊泡(Extracellular vesicles)最小的亚组(细胞外囊泡3个亚组分别为:外泌体、微泡以及凋亡小体),直径30-100 nm,密度为1.10-1.18 g/mL,表达特异性膜蛋白,如CD9、CD63和CD81。
外泌体的产生
间充质干细胞源外泌体的产生和其他细胞来源外泌体产生机制一致,都是通过胞内体途径,即细胞通过内吞作用形成早期内体(early endosome),再与高尔基复合体相互作用以形成晚期内体,进而融合形成具有许多腔内囊泡的多泡体(multivesicle bodies,MVBs),多泡体与质膜融合通过胞吐作用释放外泌体,这个过程依赖于转运必需内体分选复合物(ESCRT)的作用,因此外泌体是从内体衍生的唯一一类细胞外囊泡[2]。
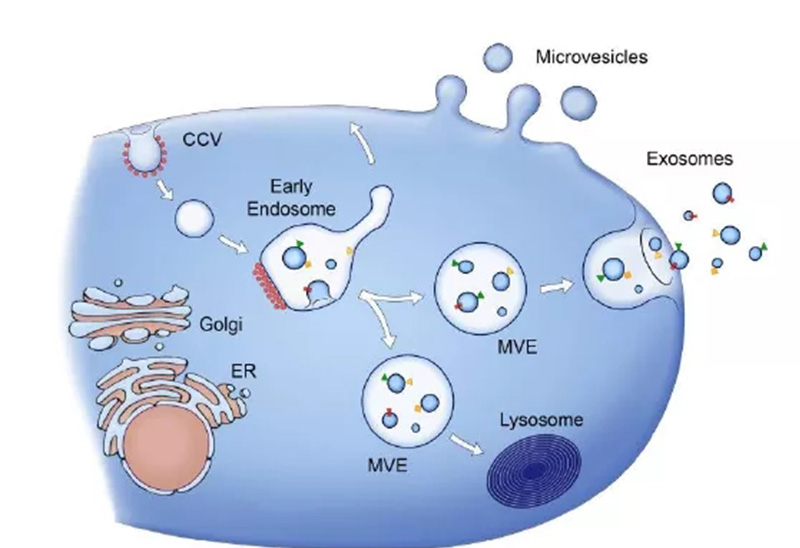
图1:外泌体的分泌过程[3]
外泌体治疗肺损伤的可能机制
01、调控MAPK信号传导通路对急性肺损伤发挥保护作用
众所周知,在急性肺损伤的发展进程中,MAPK是决定促炎细胞因子表达的关键信号通路,因此,抑制MAPK通路可能作为治疗急性肺损伤的潜在机制之一。前期研究表明人脐带间充质干细胞来源外泌体可能通过抑制内毒素诱导急性肺损伤大鼠肺组织MAPK通路中的p-JNK、p-P38、p-ERK蛋白表达,起到抑制细胞凋亡、抑制促炎因子的表达和促进肺组织细胞增殖修复等效应,从而发挥对肺组织的保护作用[4]。
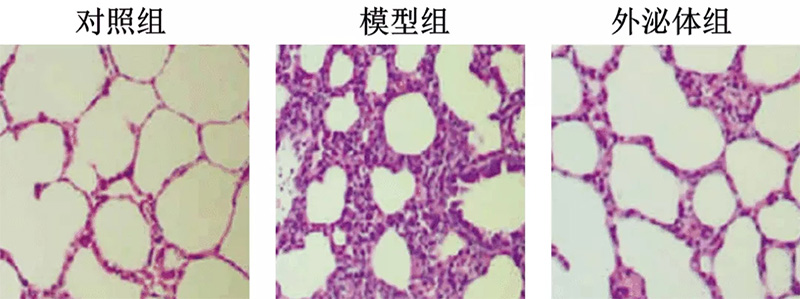
图5 不同处理组大鼠肺组织病理图(HE,×200)3
腹腔注射内毒素建立急性肺损伤模型,模型组肺组织可见大量炎症细胞浸润、不同程度充血和出血、肺间隔
增厚等肺损伤表现,尾静脉注射外泌体可明显降低肺损伤程度。
02、通过转移RNA对急性肺损伤发挥保护作用
miRNA是一类独特的小单链非编码RNA,通过与靶mRNA中的互补序列结合,抑制转录或降解特定mRNA的表达,在调节细胞基因表达中发挥关键作用。外泌体作为转运miRNA的载体,可通过转移miRNA来实现细胞间的通讯,即将其递送至受体细胞(包括肺组织细胞或免疫细胞)来改变其生理状态,从而参与肺部疾病的病理发生过程。Park等[5]发现间充质干细胞处理急性肺损伤大鼠模型后肺组织表达不同的miRNA,其中5种miRNA 显 著 上 调 (miR-1843-3p, miR-323-3p, miR-183-5p,mi R-182和miR-196b-3p),4种miRNA显著 下 调 (miR-547-3p , miR-301b-5p, miR-503-3p 和miR-142-3p),这些miRNA与炎症反应、细胞凋亡、细胞增殖和免疫应答有关,它们的改变参与了间充质干细胞对急性肺损伤的免疫调节。
03、可能通过转移线粒体DNA对急性肺损伤发挥保护作用
在急性肺损伤发生发展中,由线粒体产生的活性氧会导致线粒体DNA转录缺陷和线粒体功能障碍,而线粒体的异常会影响细胞产能功能障碍,加重急性肺损伤的严重程度,因此,改善线粒体功能可能是急性肺损伤治疗的重要手段。许多实验研究证实了从间充质干细胞到肺泡上皮细胞和内皮细胞的线粒体转移是间充质干细胞在急性肺损伤动物模型中发挥保护作用的重要机制[6]。

脂多糖(lipopolysaccharides,LPS)处理增加肺泡细胞中连接蛋白43的表达,连接蛋白促进骨髓源性干细胞(bone marrow-derived stem cells,BMSCs)与肺泡上皮细胞的附着,并产生囊泡和纳米管以与受损细胞共享线粒体以防止急性肺损伤。
应用前景与挑战
如上所述,越来越多的实验研究发现间充质干细胞来源外泌体可以预防早期缺氧引起的肺部炎症,修复内皮屏障,减轻肺水肿,恢复肺泡清除率,改善急性肺损伤患者的呼吸功能。与直接输注间充质干细胞或单分子药物治疗相比,间充质干细胞来源外泌体的优越性主要表现在:
1.外泌体来自细胞并且是非自我复制的,可以降低医源性肿瘤形成的风险;
2.作为一种新型的无细胞疗法,其尺寸很小并且能够深入到大多数组织内部,而间充质干细胞太大而不能容易地通过毛细血管循环;
3. 有良好的生物稳定性,可被修饰并装载药物;
4. 表达MHC Ⅰ或Ⅱ类抗原,具有良好的生物相容性;
5. 可对其表面特异性受体或抗体进行加工,以实现将治疗性的分子靶向送至目的细胞等。显然,间充质干细胞来源外泌体的这些特性使得其在治疗急性肺损伤中存在良好的应用前景。
然而,要使间充质干细胞来源外泌体能够真正转化为临床应用,仍然有不少挑战。首先,关于间充质干细胞来源外泌体治疗急性肺损伤的研究证据几乎全部来自临床前期研究,而且多数是以细胞或基因水平研究为主,其应用于人体后是否仍有类似的治疗作用,尚不得而知;其次,关于间充质干细胞来源外泌体治疗急性肺损伤的作用机制研究仍然相当有限,间充质干细胞来源外泌体是通过单一机制还是联合机制发挥作用仍不清楚,且是否存在更多的作用机制还需要更多的研究予以解答;最后,如何大规模地生产出适用于治疗急性肺损伤的同质化的间充质干细胞来源外泌体是另一挑战,如何确定用于治疗急性肺损伤的最佳条件,同样是其应用于临床前需要解决的问题。
总之,较多相关研究显示了间充质干细胞来源外泌体治疗急性肺损伤的巨大前景,有望成为急性肺损伤的有效治疗手段,但距离其真正应用于临床仍有不少困难,需要更多研究进行更多探索。
参考文献:
[1] G. Bellani, J.G. Laffey, T. Pham, E. Fan, L. Brochard, A. Esteban, L. Gattinoni, F. Van Haren, A. Larsson, D.F. Mcauley, Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries, JAMA The Journal of the American Medical Association 315(8) (2016) 788.
[2] R.C. Lai, R. Yeo, S.K. Lim, Mesenchymal stem cell exosomes, Seminars in Cell & Developmental Biology 40 (2015) 82-88.
[3] G. Raposo, W. Stoorvogel, Extracellular vesicles: Exosomes, microvesicles, and friends, Journal of Cell Biology 200(4) (2013) 373-383.
[4] 杨尧, 朱耀斌, 李志强, 范祥明, 刘扬, 续玉林, 张晶, 间充质干细胞外泌体对大鼠急性肺损伤的保护作用, 中华实用诊断与治疗杂志 2017年31卷7期 628-631页 ISTIC (2017).
[5] P. Joonhong, J. Sikyoung, P. Kicheol, K. Yang, S. Soyoung, Expression profile of microRNAs following bone marrowderived mesenchymal stem cell treatment in lipopolysaccharideinduced acute lung injury, Experimental and Therapeutic Medicine (2018).
[6] M.N. Islam, S.R. Das, M.T. Emin, M. Wei, L. Sun, K. Westphalen, D.J. Rowlands, S.K. Quadri, S. Bhattacharya, J. Bhattacharya, Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury, Nature Medicine 18(5) (2012) 759-765.