发布时间:2022-04-25 浏览量:0

1、TCR-T受到了更多关注
为了让T细胞拥有杀死肿瘤细胞的能力,可以在体外对T细胞进行工程,使其表达肿瘤抗原特异性T细胞受体(TCR),产生被名为TCR工程T细胞(TCR-T)的产物。与嵌合抗原受体(CAR)不同的是,TCR识别来自所有细胞隔室蛋白质的人类白细胞抗原提呈的多肽。在过继细胞疗法(ACT)中使用TCR-T细胞得到了越来越多的关注,特别是随着ACTs治疗实体癌的努力不断加强。TCR-T这颗在ACT中冉冉升起的新星受到了更多关注。
在这篇《Cancer Therapy With TCR-Engineered T Cells:Current Strategies, Challenges, and Prospects》于2022年3月发表的综述中,详细描述了CAR和TCR介导的T细胞抗原识别和信号转导的不同机制[1]。
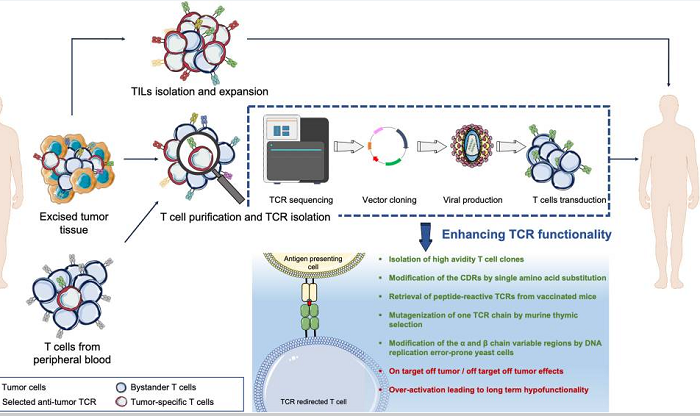
图1:TCR是什么
2、TCR-T和CAR的不同
传统的T细胞通过它们的T细胞受体(TCR)识别MHC提呈的抗原,TCR是一种由α和β链组成的二硫键连接的异源二聚体。为了形成功能性受体,TCRα/β异源二聚体进一步与CD3ϵ/γ/δ/z亚基形成络合物。TCR识别由MHC分子(pMHC)呈现在细胞表面的酶切肽。在人类中,抗原呈递的MHC等位基因被广泛地归类为HLAI类(A、B或C)或HLAII类(DR、DP或DQ),它们分别主要呈现胞内或细胞外衍生多肽。辅助受体CD8和CD4分别通过与MHC I或II类分子相互作用来增强TCR抗原的敏感性.
TCR与同源的pMHC结合导致CD3亚单位细胞内区域免疫受体酪氨酸激活基序(ITAM)的磷酸化,从而导致T细胞激活,并通过分泌穿孔素和颗粒酶启动效应功能,包括增殖、细胞因子分泌和细胞溶解(图2)。在TCRT治疗中,T细胞被编辑以表达TCRα和TCRβ链,从而赋予所需的特异性。在这里,引入的TCRα和β链与内源性CD3组分二聚体和复合体形成功能性TCR,将T细胞特异性重定向到目标抗原。
另一种重定向T细胞特异性的常见方法是通过嵌合抗原受体(CARS)的基因改造技术,它广泛由一个面向细胞外的抗原结合域组成,与细胞内的免疫细胞激活信号域相连。大多数情况下,CARS通过抗体的单链可变区(ScFv)识别抗原。在典型的CAR设计中,抗原结合的单链抗体通过铰链或间隔区连接到跨膜结构域,该跨膜结构域进一步连接到细胞内的CD3z信号域。通过这种方式,单链抗体的抗原结合驱动CD3z的磷酸化和下游T细胞的激活。新一代CARS包括增加细胞内共刺激结构域,如CD28和4-1BB,进一步改善CAR-T功能和持久性(图2).
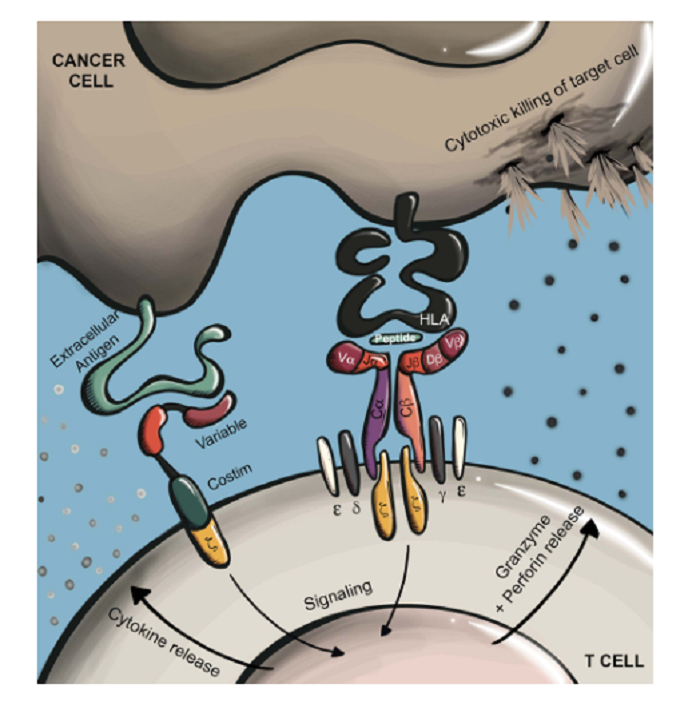
图2:TCR和CAR的不同
3、CAR vs TCR
AR识别细胞表面天然折叠的蛋白质。因此,CAR克服了TCR的人类白细胞抗原限制带来的临床局限性。人类基因组中的人类白细胞抗原编码基因是最多态的,迄今已发现20,000多个人类白细胞抗原I类等位基因。因此,与CAR T治疗不同的是,选择接受TCR T治疗的患者不仅要表达靶抗原,还必须表达相应的抗原限制性等位基因。出于这个原因,TCRT疗法通常使用仅限于相对常见的HLA等位基因的TCR,例如在美国约47.8%的高加索人和16.8%的非裔美国人中分别存在的人类白细胞抗原-A*02:01。
由于CAR和TCR使用不同的信号机制,它们在对抗原刺激的功能反应上表现出几个重要的差异。虽然TCR可以诱导对单个pMHC分子的细胞毒反应,但CAR通常需要数千个靶表面分子来介导有效的反应。CAR抗原敏感性降低的一个结果是在B细胞恶性肿瘤患者中看到的,他们最初对CAR T治疗有反应,但后来随着低抗原癌细胞的进展而复发。在刺激下,CARS介导超生理T细胞激活,导致细胞因子分泌增加。因此,与TCRT细胞相比,CAR T细胞更有可能在患者中引起细胞因子释放综合征(CRS);然而,最近的治疗进展使CAR在临床上通常是可控的。CAR识别的肿瘤抗原必须位于癌细胞的表面。相反,TCRs识别人类白细胞抗原提呈的多肽,这些多肽可能来自任何细胞隔间。由于跨膜蛋白仅占蛋白质组的大约14-26%,靶向抗原受到相当大的限制。然而,CAR不仅能够识别蛋白质抗原,而且还能识别糖蛋白和糖脂等其他分子,这在一定程度上扩大了CARS靶向抗原的范围。这种潜在靶向抗原谱系的差异对CAR T和TCR T疗法具有重大意义,这两种疗法必须积极靶向肿瘤细胞,同时避免对健康组织的毒性。
事实上,靶抗原在正常细胞上的表达可以导致T细胞介导的对健康组织的破坏,即所谓的“靶向肿瘤”毒性。因此,靶抗原由癌细胞独占表达的程度是一个重要因素。到目前为止,CAR T疗法的初步成功是针对CD19的B细胞恶性肿瘤的治疗,CD19是一种在恶性和健康的B细胞上普遍表达的抗原。虽然CD19导向的CAR T治疗导致了恶性和健康的B细胞的消融,但这种靶点外肿瘤毒性在临床上是可以通过替代抗体治疗来处理的。然而,在许多其他类型的癌症的情况下,包括几乎所有的实体癌,这种T细胞介导的健康器官组织的消融在临床上是无法处理的,因此在癌细胞中具有排他性表达的靶抗原是最好的。
目前所描述的在癌细胞中表达具有最高特异性的肿瘤抗原主要是细胞内来源的抗原,可与TCR结合,但不能与CAR结合。因此,TCRT疗法在侵袭性靶向癌细胞的能力上可能比CAR T疗法更具优势,同时将毒性降至最低。
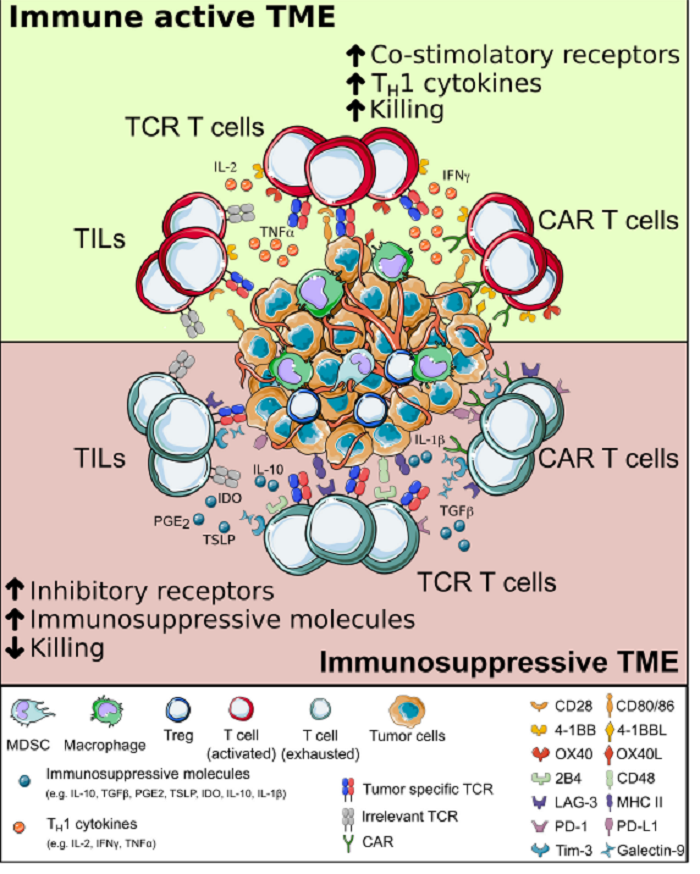
图 3 TCR和CAR对肿瘤细胞进行杀伤
4、谁才是未来?
通过对现在TCR-T和CAR-T的研究和试验我们不难看出,TCR-T和CAR-T其实各具优势,没有碾压的性能,只是精通的领域不同,像是CAR-T在血液肿瘤领域已经取得了辉煌的成就。但在未来TCR-T会在实体肿瘤方面有更强的优势。我们有理由相信,CAR-T和TCR-T双向共同发展才是免疫细胞领域的未来。
参考文献:
[1] Shafer P, Kelly LM, Hoyos V. Cancer Therapy With TCR-Engineered T Cells: Current Strategies, Challenges, and Prospects. Front Immunol. 2022 Mar 3;13:835762. doi: 10.3389/fimmu.2022.835762. PMID: 35309357; PMCID: PMC8928448.