发布时间:2022-08-10 浏览量:0

1995年报道了在恶性血液肿瘤患者中进行骨髓间充质干细胞(Mesenchymal Stem Cells,MSCs)的临床试验,MSC是继造血干细胞之后又一类在世界范围内广泛应用于临床研究的干细胞。目前全球已上市的数十种干细胞治疗药品中,以MSC为主。
MSC 是一类具有自我更新和多向分化能力的非造血来源的多能干细胞。可以说,从生命伊始,人体内就有MSC的身影,比如胚胎、围产期组织(如脐带、 胎盘、羊膜、脐带血、绒毛膜)和成人体组织(如骨髓、脂肪、皮肤、牙髓、滑膜、肝脏)。近年来,干细胞研究及应用已成为衡量一个国家生命科学与医学发展的重要指标。
那么,干细胞到底是什么?干细胞疗法是什么?简单讲,干细胞就是人人体内都有的一种活细胞,用干细胞来治疗疾病的技术,就是干细胞治疗技术,这是一项可以“取之于人,用之于人”的再生医学技术。
自2020年新冠暴发以来,新冠相关肺炎和急性呼吸窘迫综合征(ARDS)已成为MSC临床研究的第二大适应症。快速的全球反应和新冠相关MSC试验的增加突出了MSC在治疗感染性疾病方面的前景。在炎症微环境中,促炎细胞因子如IL-1β、IL-6、IL-23、IFN-γ和TNF-α,可以刺激炎症反应MSCs分泌抗炎症因子,如TNFα刺激基因(TSG)-6,一氧化氮(NO),IL-10,半乳糖凝集素,前列腺素E2(PGE2),转化生长因子(TGF)-β。因此,MSC成为治疗慢性炎症性皮肤疾病的理想治疗方式,比如糖尿病足。But!!!MSC不能在移植患处被长期保留,且存活时间短暂,成为MSC治疗糖足的主要挑战。

简单讲,外泌体是多种细胞释放的小囊泡,多小呢?直径40-160 nm左右。打个比方,头发丝直径一般是40-50μm。一个100 nm的外泌体只有头发丝的1/500那么大。如此小的外泌体确实很容易被忽略。1981年,研究人员在体外培养的肿瘤细胞上清液中观察到小的膜性囊泡,并将其命名为外泌体。当时,人们认为外泌体只能作为细胞的废物处理系统。随着电子显微镜技术的不断发展,Johnstone等人在网织红细胞成熟的研究过程中,首次分离出了外泌体,并在外泌体膜上发现了一种转移受体。
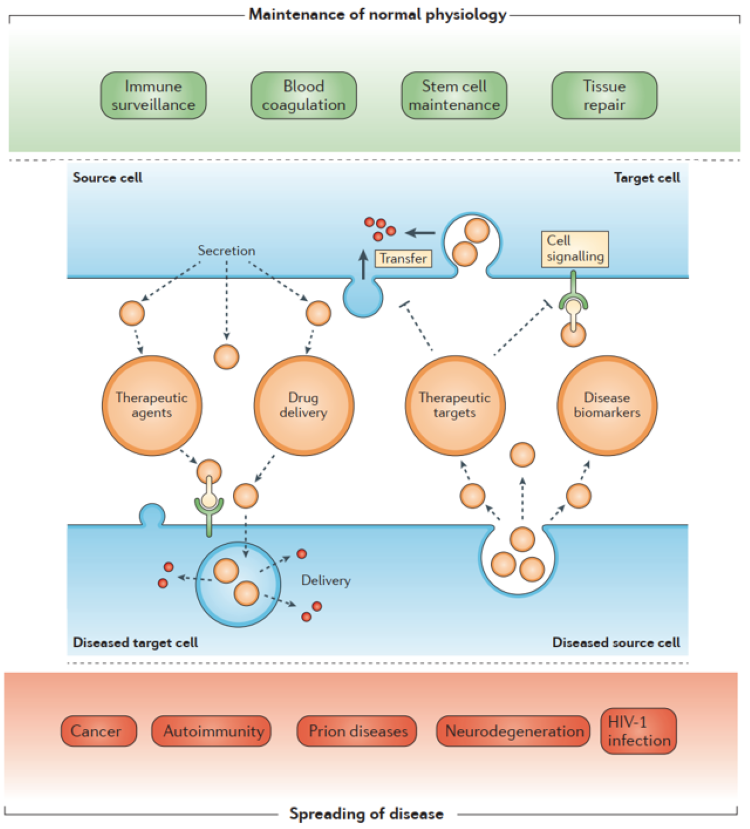
进一步的研究表明,外泌体参与了多种生物过程,如抗原呈递、免疫反应、肿瘤生长和细胞分化。外泌体通过在体液中循环,在细胞之间传递物质和信息,从而参与人体的多种生理和病理过程。外泌体在体液中的循环允许它们进入附近或远处的靶细胞,并通过直接融合、内吞和受体配体的结合在其有效载荷的传递中发挥作用。
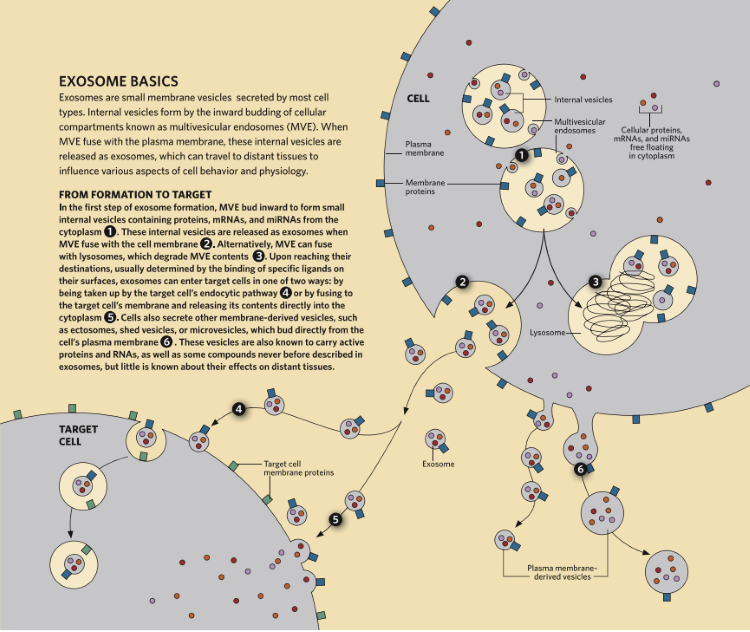
外泌体的产生及细胞通讯[1]
干细胞源外泌体(MSC-exo)是 MSC 分泌的独特的亚细胞结构的物质,从而介导了一些归属于MSC的生物学功能,如组织再生、免疫调节和神经保护。脐带间充质干细胞来源外泌体具有促进抗凋亡,促血管生成和抗纤维化活性,特别是表现出与母细胞相似的免疫调节作用。外泌体疗法在精确医学中的潜力基于它们在体内的普遍性、易获得性和稳定性。例如,MSC-exo具有触发免疫反应和降低异位移植的潜在风险的低倾向。同时,MSC-exo 体积小,易通过肺循环,无血栓形成风险,临床应用形式多端,除了静脉滴注、可轻易通过雾化、吸入、气管滴注、局部介入等手段辅助临床治疗。
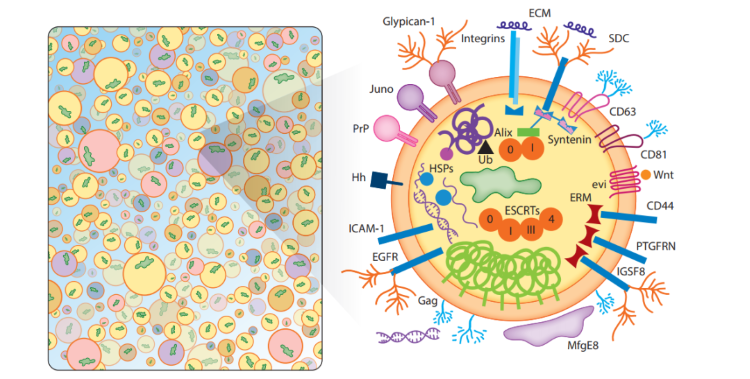
外泌体内容物

糖尿病慢性难愈性溃疡是指糖尿病患者由于机体长期慢性高血糖导致皮肤软组织血运障碍、神经 病变,在皮肤受损情况下造成 3 个月以上迁延不愈的创面,常见于足部,是糖尿病最为棘手且严重的并发症之一,是创面治疗的难题。发病机制复杂、治疗时间长、费用高、致残率高是糖足特有的标签。国际糖尿病联盟资料表明,70%的截肢手术发生在糖尿病患者身上,仅在美国,每年的治疗费用就高达91亿美元。外泌体中包含的miRNAs在糖尿病及其相关并发症的进展中至关重要。
研究表明,MSC-exo有利于糖尿病足的再生过程,包括炎症阶段、血管生成阶段、再上皮化和重构阶段。外泌体内容物,miRNAs和蛋白质,如DMBT1、OxOband、NRF2、miR-21、miR-23a、miR-124a、miR125b、miR126、lncRNAH19,letR-7b、miR-130a,miR-132通过激活靶向信号通路调节免疫反应、自噬和新生血管、促巨噬细胞向M2型极化[2, 3]。
据报道,在伤口愈合的早期,外泌体促进I型和III型胶原的表达而缩短愈合时间;而在损伤修复后期,则可能通过抑制胶原合成,尽量减少疤痕形成[4]。外泌体还可能通过在皮肤伤口愈合过程中上调PI3K/Akt途径来促进和优化胶原蛋白的合成[5]。将HaCaTs暴露于过氧化氢中以建立皮肤损伤模型,发现外泌体可以通过Wnt/β-catenin信号通路促进HaCaTs的增殖、迁移和抑制细胞凋亡[6]。
此外,外泌体在患处的持续释放与保留仍然是exo应用的限制,通过开发组织工程材料或者直接与伤口敷料的复合,增加外泌体在伤口处的作用时间,以达到有效的修复效果。外泌体与透明质酸(HA)结合,能够激活伤口表面的HDFs活性,并增强了伤口表面的再上皮化和血管化[7]。基于良好的应用态势以及易于生产、包装、存储、产业化等优势,MSC-exo未来将有望进入临床转化,成为治疗糖足的又一潜力策略。
外泌体的生理病理作用
1. Théry, C., Exosomes: secreted vesicles and intercellular communications. F1000 Biol Rep, 2011. 3: p. 15.
2. Casado-Díaz, A., J.M. Quesada-Gómez, and G. Dorado, Extracellular Vesicles Derived From Mesenchymal Stem Cells (MSC) in Regenerative Medicine: Applications in Skin Wound Healing. Front Bioeng Biotechnol, 2020. 8: p. 146.
3. Zhang, D., et al., Metformin Improves Functional Recovery After Spinal Cord Injury via Autophagy Flux Stimulation. Mol Neurobiol, 2017. 54(5): p. 3327-3341.
4. Li, H., et al., Exosomes derived from human adipose mensenchymal stem cells accelerates cutaneous wound healing via optimizing the characteristics of fibroblasts. 2016. 6: p. 32993.
5. Zhang, W., et al., Cell-free therapy based on adipose tissue stem cell-derived exosomes promotes wound healing via the PI3K/Akt signaling pathway. Exp Cell Res, 2018. 370(2): p. 333-342.
6. Tao, et al., Adipose mesenchymal stem cell-derived exosomes promote cell proliferation, migration, and inhibit cell apoptosis via Wnt/β-catenin signaling in cutaneous wound healing. 2019.
7. Liu, K., et al., Adipose stem cell‐derived exosomes in combination with hyaluronic acid accelerate wound healing through enhancing re‐epithelialization and vascularization. 2019.