发布时间:2022-09-27 浏览量:0

1、前言
皮肤经常会由于急性或慢性创伤而受损,比如大面积的烧伤、创伤或糖尿病性溃疡等。而这些风险不仅会破坏皮肤的屏障功能,还会改变人体对温度、疼痛和触觉的感知。另外,这类皮肤创伤还会给患者的身心健康造成不良的影响,同时也会给社会带来巨大的经济负担。因此,迫切需要寻找一种促进皮肤再生和恢复受损皮肤功能的有效途径。
近年来,间充质干细胞(mesenchymal stromal cells, MSCs)在皮肤的修复和再生中受到了广泛的关注。MSC是一种未分化的成体干细胞,可以自我更新并分化成多个谱系。因其易于分离,免疫原性低,而为组织再生创造了良好的环境。
目前,对于MSC在治疗疾病中的作用机制尚不明确,专家学者认为,MSC在体内主要通过旁分泌信号实现治疗作用,而在这其中,外泌体(exosomes)是MSC旁分泌作用的关键生物活性囊泡,它主要通过影响受体细胞的生存、增殖、迁移和基因表达来调节许多生理和病理过程(图1)。因此,MSC衍生的外泌体(MSC-exosomes)在皮肤再生中发挥的作用意义重大。
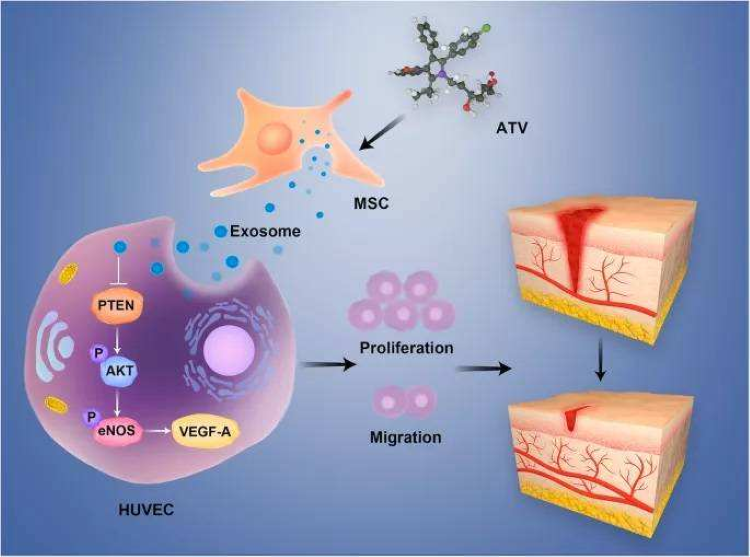
图1:MSC分泌外泌体发挥组织修复作用
2、外泌体的生物来源
胞外囊泡根据其大小和来源不同,可分为三种类型:凋亡小体、微囊泡和外泌体(图2)。其中凋亡小体是凋亡细胞质膜释放出来的胞外最大的一组囊泡,直径约为1000 nm。微囊泡是质膜向外出芽时产生的较大的胞外囊泡,直径在100-1000 nm。外泌体是主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中,直径在50-100nm。到目前为止,几乎所有已检测到的活细胞都能分泌外泌体,包括正常上皮细胞、肿瘤细胞、B细胞、T细胞、肥大细胞和树突状细胞等。
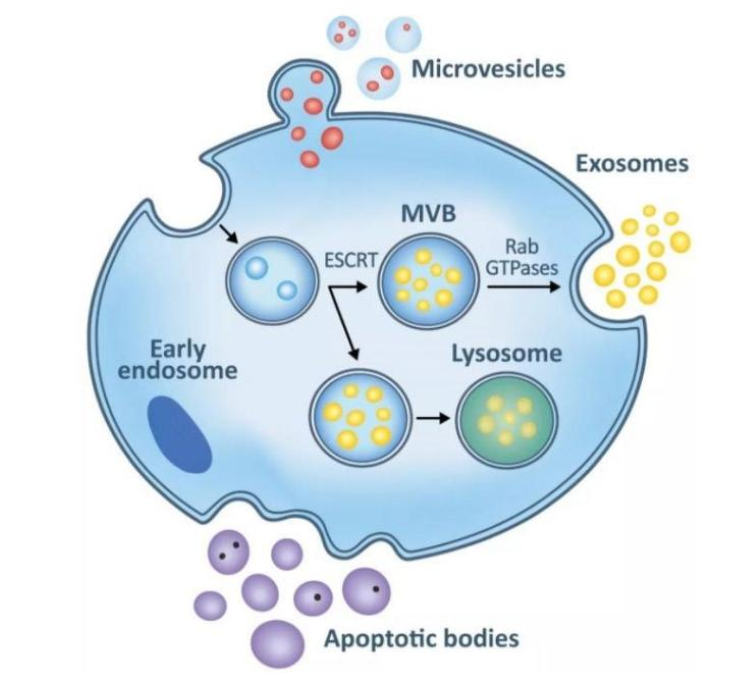
图2:凋亡小体、微囊泡和外泌体形成机制
3、受损组织的免疫调节作用
炎症是机体应对有害刺激的一种自卫机制,其目的是恢复机体内稳态的平衡。据研究报道,当皮肤损伤后24-36小时,中性粒细胞作为主要的细胞类型,最初被招募到损伤部位。随后,中性粒细胞通过吞噬作用来清除外来颗粒、病原体或受损组织细胞。在皮肤损伤后48-72h,巨噬细胞被招募到创面并继续吞噬过程。因此,炎症是皮肤再生过程的一个重要步骤。
巨噬细胞是皮肤再生过程中主要的炎性细胞,主要表现为促炎M1型和抗炎M2型,这些特定的细胞表型会影响皮肤再生的每个阶段。此外,存在于伤口组织中的B细胞和T细胞在伤口愈合中也发挥着关键作用。MSC-exosomes可调控B细胞的活化、分化和增殖,也可抑制T细胞的增殖,而且MSC-exosomes可将活化的T细胞转化为T调节表型,从而发挥免疫抑制作用(图3A)[1]。总之,MSC-exosomes可以抑制炎症,但其具体的作用机制尚不清楚。
研究报道,MSC-exosomes通过miRNAs发挥免疫调节作用。有专家学者发现,脂多糖预处理的MSC-exosomes转染的miRNA-let7b可以通过抑制toll样受体4(TLR4)/NF-κB通路和激活信号转导以及转录激活因子3(STAT3)/蛋白激酶B(AKT)信号通路来调节巨噬细胞的极化,从而解决慢性炎症,进而促进皮肤伤口的修复[2]。此外,研究表明,携带miRNA-181c的hucMSC-exosomes通过下调TLR4信号通路,可减轻烧伤引起的过度炎症(图3B)[3]。
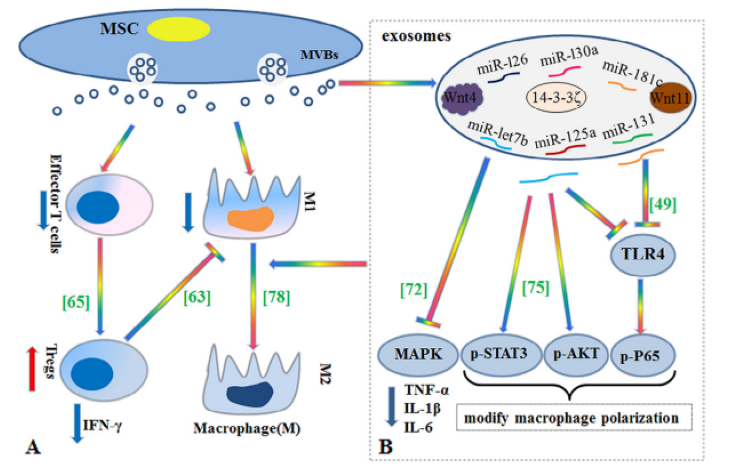
图3:MSC-exosomes的免疫调节作用
(A) MSC-exosomes可调控B细胞的活化、分化和增殖,也可抑制T细胞的增殖,MSC-exosomes可将活化的T细胞转化为T调节表型,
从而发挥免疫抑制作用。(B) MSC-exosomes通过传递特定的microRNAs,促进巨噬细胞向抗炎M2表型转化
4、受损组织中的血管生成
新血管的形成是各种生理和病理过程中的关键步骤,包括伤口的愈合和组织修复。许多研究报道,MSC-exosomes在不同疾病模型中的局部应用,可诱导新血管的形成。诱导多能干细胞(hiPSC)MSC-exosomes在体外能促进人脐静脉内皮细胞的增殖、迁移和血管的形成,而且外泌体移植到创面,会诱导新血管的形成和成熟,可促进皮肤创面的愈合[4]。因此,MSC-exosomes在新血管的形成中起着关键作用。
5、皮肤细胞增殖和上皮再生
当皮肤损伤后,一般从第三天开始进入细胞增殖期。此后,开始产生成纤维细胞并增殖,然后产生细胞外基质(ECM),包括纤维连接蛋白、I型和III型胶原蛋白。此外,上皮细胞增 殖并开始向伤口边缘迁移,从而加速伤口闭合,以减少皮肤的感染。因此,细胞增殖和皮肤再上皮化是皮肤再生的关键。多项研究表明,不同细胞来源的外泌体,包括富血小板血浆(PRP)、hiPSC-MSCs和hucMSCs,都可以促进皮肤细胞的增殖和加速上皮再生(图4)[5]。
图4:不同细胞来源的外泌体促进细胞增殖和上皮再生过程
6、皮肤重塑的影响
严重的创伤和大面积的烧伤,通常会由于肌成纤维细胞过度聚集和ECM沉积而导致疤痕形成,而疤痕的形成不仅影响视觉外观,而且会影响器官的功能。多项研究表明MSC-exosomes可抑制疤痕形成。通过高通量测序和功能分析证明,hucMSC-exosomes中携带的miRNA-125b和miRNA-145,在创面愈合过程中,可以通过抑制转化生长因子TGF-β/SMAD2通路来抑制成纤维细胞分化和过度聚集,进而减少过度纤维化和瘢痕形成[6]。
7、相关的临床研
迄今为止,在全球范围内,MSC-exosomes相关的临床研究有282例,这其中有正在招募患者的,有一些研究正在进行但还未完成,还有一些已经立项但还未开始,已经完成的只有66例。这些临床研究涉及到了癌症、心脑血管疾病、精神疾病、糖尿病和骨骼疾病等领域,仅有1例研究与皮肤再生相关。
该例用于皮肤再生的临床研究旨在评估MSC-exosomes软膏在成年健康受试者(第1天到第20天)反复局部应用的安全性和耐受性,研究结果是提供有关该受试药物安全性的第一临床信息,并为在随后的临床研究中评价MSC-exosomes软膏的给药选择提供信息。
8、展望
经过多年的研究证实,MSC-exosomes对于皮肤的损伤方面表现出了良好的修复效果,作为MSC的安全的替代品,一种新的无细胞疗法,为皮肤损伤的修复开辟了新的领域,具有广阔的临床应用前景。但目前对于MSC-exosomes促进组织修复和皮肤再生的机制尚不明确,仍处于起步阶段,对于怎样优化分离提取和纯化来提高外泌体的产量,以及采取怎样的预处理方法才能增强外泌体的治疗效果等问题仍待进一步探索研究。因此,将外泌体应用于于临床还需要很多的工作要做。
[1] Ti D, Hao H, Tong C, Liu J, Dong L, Zheng J, et al. LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b. J Transl Med 2015; 13:308.
[2] Ti D, Hao H, Fu X, Han W. Mesenchymal stem cells-derived exosomal microRNAs contribute to wound inflammation. Sci China Life Sci 2016; 59:1305–12.
[3] Li X, Liu L, Yang J, Yu Y, Chai J, Wang L, et al. Exosome derived from human umbilical cord mesenchymal stem cell mediates MiR-181c attenuating burn-induced excessive
inflammation. EBioMedicine 2016; 8:72–82.
[4] Pashoutan Sarvar D, Shamsasenjan K, Akbarzadehlaleh P. Mesenchymal stem cell-derived exosomes: new opportunity in cell-free therapy. Adv Pharm Bull 2016; 6:293–9.
[5] Carrascoramírez P, Greening DW, Andrés G, Gopal SK, Martín-Villar E, Renart J, et al. Podoplanin is a component of extracellular vesicles that reprograms cell-derived exosomal proteins and modulates lymphatic vessel formation. Oncotarget 2016; 7:16070–89.
[6] Lo Sicco C, Reverberi D, Balbi C, Ulivi V, Principi E, Pascucci L, et al. Mesenchymal stem cell-derived extracellular vesicles as mediators of anti-inflammatory effects: endorsement of macrophage polarization. Stem Cells Transl Med 2017; 6:1018–28.