发布时间:2022-11-09 浏览量:0


过敏性疾病已经成为一个全球性的健康问题,最常见的过敏性疾病包括过敏性哮喘、过敏性皮肤病、过敏性鼻炎和过敏性结膜炎。在过敏性疾病的治疗中,皮质类固醇、抗组胺、抗白三烯和β2肾上腺素能受体激动剂可暂时抑制炎症介质和免疫细胞,然而长期治疗便会产生诸多不良反应,耐药和不耐受也限制了部分患者的应用。因此,过敏性疾病急需一种新的治疗方法。
间充质干细胞(MSCs)是在新生儿和成人组织中发现的多功能、非造血性的基质前体细胞,因其具备较强的自我更新和分化功能而具有一定的组织修复能力。在免疫调节功能上,MSCs对T细胞、B细胞、树突状细胞(DC)和自然杀伤细胞(NK)有明显的抑制作用,进而影响先天免疫和适应性免疫(图1)[1]。MSCs广泛应用于各种自身免疫性疾病,包括系统性红斑狼疮(SLE)、移植物抗宿主病(GVHD)、多发性硬化症(MS)和类风湿关节炎(RA)。此外,一些研究人员发现MSCs能够一定程度的减轻过敏性疾病,包括支气管哮喘、特应性皮炎和过敏性鼻炎等,这表明MSCs具有一定的抗炎能力,并可在不同疾病特异性炎症条件下发挥保护作用[2],预示着MSCs可能成为过敏性疾病的潜在研究方法。
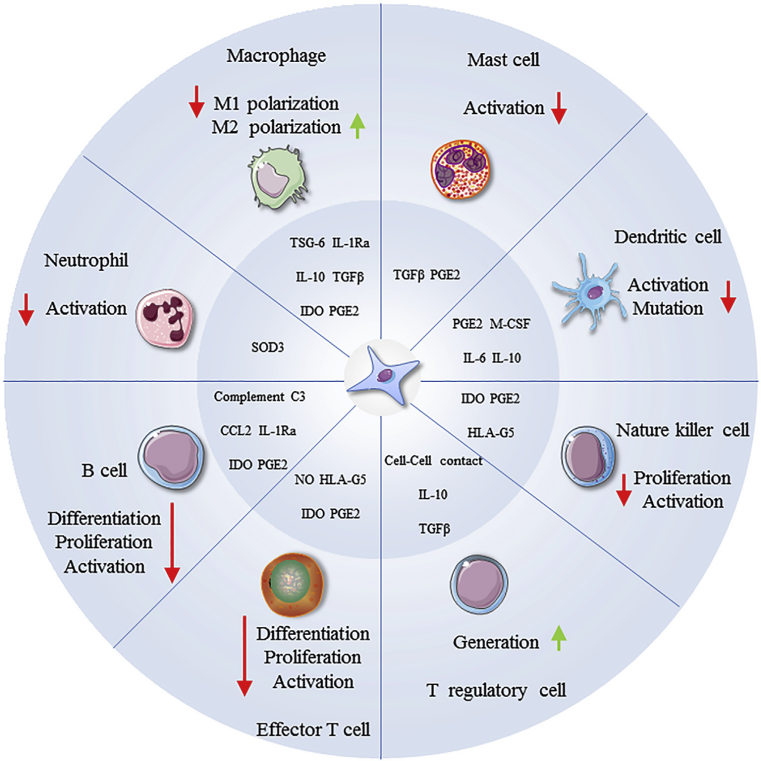
图1 :MSCs对免疫细胞的调节作用
注:B细胞和效应T细胞分化、增殖和生成的抑制作用;促进调节性T细胞(Treg)的生成;抑制NK细胞增殖和活化;抑制DC细胞成熟和激活;抑制肥大细胞(MC)和中性粒细胞激活;抑制促炎M1巨噬细胞表型,增强抗炎M2巨噬细胞表型;MSCs的免疫抑制作用是由可溶性因子和细胞接触介导的。

支气管哮喘(BA)是一种炎症性疾病,其特征是气道炎症和收缩而导致的气道结构变化,通常是对感染、过敏原或其他污染物的反应。在BA过程中, DC细胞、初始T辅助细胞(Th0)及其细胞因子的聚集干扰了气道结构型细胞的正常功能和增殖,导致过敏性气道炎症(AAI)和气道重塑。目前,吸入皮质类固醇和β2肾上腺素能受体激动剂以及口服白三烯抑制剂用于控制哮喘症状,但不能促进受损组织的修复,无法彻底的治疗哮喘,仍有5-10%的哮喘患者存在症状。
一些研究表明,MSCs可以减少BA患者肺部的炎症和进行组织重塑。Bonfield等人证实,人骨髓间充质干细胞(BM-MSCs)治疗是有效的,并特异性降低了嗜酸性粒细胞为主的小鼠哮喘模型中的AAI[3]。此外,Sun等人研究表明,在哮喘造模过程中,通过抑制炎症细胞的浸润和粘液分泌,同时伴随着血清和支气管肺泡灌洗液(BALF)中Th2免疫球蛋白水平的降低,使用人诱导的多能干细胞来源的MSCs (iPSC-MSCs)和BM-MSCs治疗,可防止过敏的特异性病理改变[4]。此外,BM-MSCs对严重的中性粒细胞为主的哮喘有较好的治疗作用,这种哮喘的特点是对类固醇药物反应性低,甚至耐药。这些研究都证实了MSCs在BA中的抗过敏特性和研究作用(图2)[5],表明其具有广阔的临床应用前景。

图2:MSCs对哮喘的免疫调节作用
注:在哮喘的发展进程中,MSCs通过抑制DC的迁移和募集来阻止DC和T细胞分化的抗原递呈过程;MSCs通过抑制Th1和Th17细胞的反应,促进抗炎M2巨噬细胞极化,抑制中性粒细胞激活;巨噬细胞通过吞噬MSCs转化为抗炎M2表型;MSCs也抑制Th2反应,以阻止B细胞的IgE分泌、嗜酸性粒细胞的激活和MC的脱颗粒;MSCs通过调节HO-1、IDO和TGF-β等可溶性因子来增强Treg的数量和IL-10的分泌;MSCs还通过诱导半成熟DC表型和增加M2巨噬细胞IL-10分泌来促进Treg功能。

应性皮炎(AD)是一种典型的皮肤炎症性疾病,以湿疹性皮肤病变和严重瘙痒为特征。目前,大约有20%的儿童和10%的成年人患有AD。这些患者,特别是中度至重度的患者,通常有与睡眠障碍相关的抑郁和焦虑情绪。
MSCs能够调节免疫细胞的功能,被认为是研究AD的潜在方法(图3)[6]。Na等人证实,在AD小鼠模型中,静脉给药BM-MSCs,抑制了皮肤组织中的炎性细胞浸润,降低了血清中的IgE水平,IL-4在淋巴结和皮肤组织中的表达也受到抑制,进一步证实了MSCs可以抑制B细胞分化、T细胞活性和相关细胞因子的产生,对AD能产生有益的治疗作用[7]。此外,Kim等人发现,皮下注射核苷酸结合寡聚结构域2(NOD2)激活的人脐带来源的间充质干细胞(hUCB-MSCs)对AD显示出强大的研究效果,并通过增加PEG2和TGF-β1的产生抑制了MC的浸润和脱颗粒。
MSCs在AD中的临床价值已通过临床试验(I/IIa期)得到证实。Kim等人发现,hUCB-MSCs可显著降低55%的中到重度AD患者的湿疹面积和严重程度指数评分。AD患者使用hUCB-MSCs后,整体评估评分和AD评分分别显示有33%和50%的降低,特别是瘙痒评分下降了58%。另外,hUCB-MSCs降低了AD患者血液中IgE的水平和嗜酸性粒细胞的数量,而没有发生严重的不良反应。这项临床研究首次证实了异体MSCs研究AD的有效性和安全性。
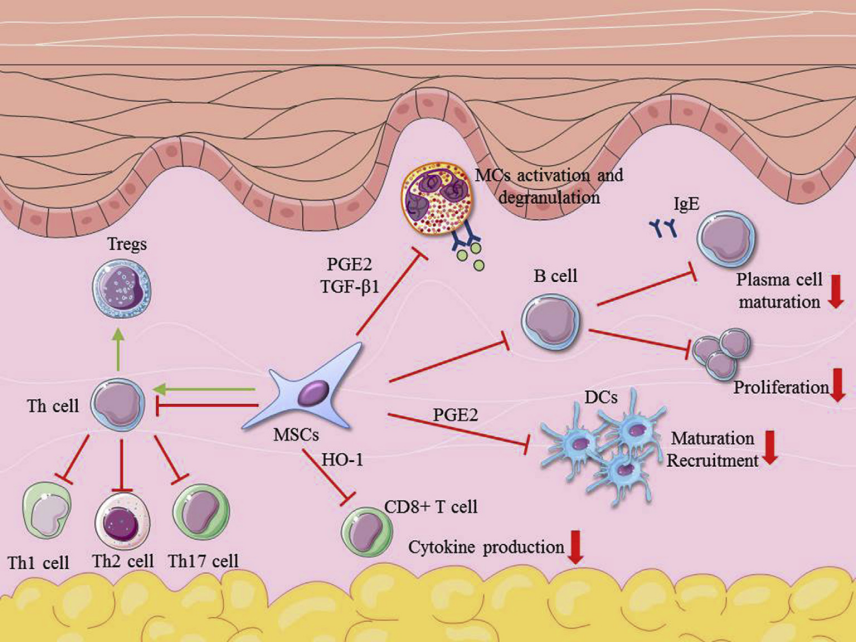
图3:间充质干细胞对过敏性皮肤病的免疫调节作用
注:在过敏性皮肤病进程中,MSCs通过介导PGE2抑制DC的迁移和募集;MSCs抑制Th细胞的分化和Th1、Th2、Th17细胞的反应;MSCs抑制CD8+T细胞的细胞因子的产生,抑制B细胞的增殖和IgE分泌;MSCs通过调节PGE2和TGF-β1,抑制MC的激活和脱颗粒。

过敏性鼻炎(AR),又称变应性鼻炎,是指特应性个体接触变应原后,主要由IgE介导的介质(主要是组胺)释放,并有多种免疫活性细胞和细胞因子等参与的鼻黏膜非感染性炎性疾病。对于AR的治疗,主要包括MC稳定剂、抗组胺剂、白三烯受体拮抗剂和类固醇。然而,即使运用最好的药物治疗,约20%的AR患者仍然症状严重。
近年来,MSCs被证实可一定程度的抑制炎症,是一种很有使用前景的AR研究方法。Cho等人发现,在AR小鼠模型中,MSCs可以定位于鼻黏膜并通过对过敏原的Th2型免疫反应转变为Th1型反应,减少嗜酸性粒细胞的浸润,从而有效的缓解AR的症状[8]。Yang等人发现,外源性MSCs迁移到有炎症的鼻组织,通过上调IFN-γ水平,增强了Th1免疫应答,而通过下调IL-4、IL-5和IL-10表达,抑制了Th2免疫应答,从而减弱了病理改变。
2021年10月,齐鲁细胞治疗公司与烟台毓璜顶医院合作开展的名为 “人脐带间充质干细胞注射液治疗中-重度持续性变应性鼻炎的临床研究”的项目通过了国家卫健委的备案审批,该项目是全球首个干细胞治疗变应性鼻炎的临床研究,开启了过敏性鼻炎的防治的新篇章。据悉,该项目目前进展非常顺利,有望在年内完成全部入组。(临床试验注册号:NCT05151133)

目前的研究证明MSCs在过敏性疾病方面具有潜在的应用前景。在未来许多过敏性疾病,如哮喘、皮炎、鼻炎、结膜炎和过敏反应等,将受益于MSCs的应用。随着我们对MSCs知识的扩展,这种研究策略可能最终会专门针对于过敏性疾病。但是,不同组织来源的MSCs对于不同过敏性疾病的应用效果还有待进一步探讨,局部或全身性MSCs移植的长期疗效和持续时间尚不清楚。随着长期安全性数据和临床治疗效果的积累,更有效的方法可以使传统治疗中无法治愈的过敏性疾病患者受益。虽MSCs已被证实在过敏性疾病中具有潜在的应用价值,但增强其免疫调节功能仍存在困难,未来的研究仍需要在药效学和后续临床试验中去探索更好的使用剂量和应用方法,以期将MSCs为基础的研究方法引入临床。
参考文献:
[1] Wesemann DR, Nagler CR. The microbiome, timing, and barrier function in the context of allergic disease. Immunity 2016;44: 728-38.
[2] Ab Kadir R, Zainal Ariffin SH, Megat Abdul Wahab R, Kermani S, Senafi S. Characterization of mononucleated human peripheral blood cells. Sci World J 2012;2012: 843-843.
[3] Bonfield TL, Koloze M, Lennon DP, Zuchowski B, Yang SE, Caplan AI. Human mesenchymal stem cells suppress chronic airway inflammation in the murine ovalbumin asthma model. Am J Physiol Lung Cell Mol Physiol 2010;299: 760-70.
[4] Sun YQ, Deng MX, He J, Zeng QX, Wen W, Wong DS, et al. Human pluripotent stem cell-derived mesenchymal stem cells prevent allergic airway inflammation in mice. Stem Cells 2012;30:2692-9.
[5] Lo Furno D, Mannino G, Giuffrida R. Functional role of mesenchymal stem cells in the treatment of chronic neurodegenerative diseases. J Cell Physiol 2018;233:3982-99.
[6] Kim HS, Yun JW, Shin TH, Lee SH, Lee BC, Yu KR, et al. Human umbilical cord blood mesenchymal stem cell-derived PGE2 and TGF-beta1 alleviate atopic dermatitis by reducing mast cell degranulation. Stem Cells 2015;33:1254-66.
[7] Na K, Yoo HS, Zhang YX, Choi MS, Lee K, Yi TG, et al. Bone marrow-derived clonal mesenchymal stem cells inhibit ovalbumin-induced atopic dermatitis. Cell Death Dis 2014;5:1345.
[8] Cho KS, Park HK, Park HY, Jung JS, Jeon SG, Kim YK, et al. IFATS collection: immunomodulatory effects of adipose tissue-derived stem cells in an allergic rhinitis mouse model. Stem Cells 2009;27:259-65.

