发布时间:2023-05-09 浏览量:0

细胞外囊泡 (Extracellular vesicles,EVs)是多种由细胞积极释放的纳米级膜囊泡,是细胞间通信和循环生物标志物的重要工具,具有生物相容性、通用性、储存方便、安全性高等优点,可运输信使和非编码RNA、蛋白质、脂质、DNA等生物活性物质。
细胞外囊泡包括外泌体、核外颗粒体、外来体以及凋亡小体等。

其中外泌体是目前为止定义最为明确的细胞外囊泡。
2013年三位科学家因囊泡运输调控机制获得诺贝尔奖后,相关领域的研究迅速成为热点。
特别是近几年外泌体相关基金和文章屡创新高,全球科研大咖纷纷扎堆此领域,有关外泌体载药、诊断、预后监测、免疫疗法等方向的文章陆续发表在 Cell、Nature 等各大顶级期刊上。外泌体已成为生命科学/临床医学研究的一大热点。
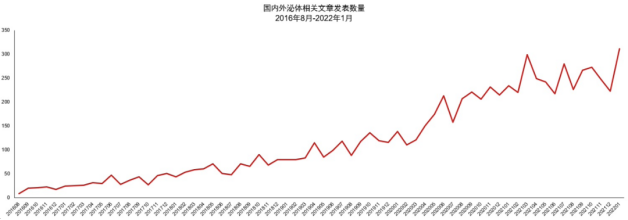
△ 国内外外泌体文章发表数量(图片来源:产业研报)
研究表明,干细胞来源的外泌体具有与干细胞等同或更优的治疗效果,并以更高的操作性、更低的免疫原性以及更利于“货架销售”等优势,成为“无细胞治疗”的不二之选,为当前很多难治疾病的治疗、“无成药性”药物靶点的新型药物的开发带来新的机会(图1)。

图一 外泌体的生物学功能和生物医学应用
尽管外泌体对多种疾病具有治疗价值,但它们的应用仍然受到一些缺点的阻碍,包括靶向效率低、治疗效果不均匀和产量低。因此,需要先进的工程技术来使外泌体功能化,从而提高它们作为疾病治疗药物的效果。
这些技术主要包括亲本细胞预处理以增强固有治疗效果、向外泌体装载治疗性药物、外泌体表面修饰以增强靶向性等。
1、亲本细胞预处理技术
预处理包括使用特定培养条件的亲本细胞进行操作,如低氧、3D培养和血清剥夺。也可以将生化刺激,包括脂多糖、一氧化氮、促炎细胞因子和外源基因,如质粒DNA和miRNAs,引入培养环境中[1-3]。细胞代谢过程产生的外泌体部分决定了细胞的遗传和表型特征,这些特征可以通过外源刺激改变[4]。然而,考虑到间充质干细胞的各种生理条件,预处理方法的优化还需要进一步研究。
2、外泌体载药技术
作为药物递送系统的一部分,外泌体可通过释放自然形成的内容物和装载的治疗剂(例如化学物质、蛋白质、肽和核酸)来处理受体细胞。
药物装载策略可分为两类:内源性(使用各种方法在亲代细胞预处理后收集载有药物的外泌体)和外源性(将外源性药物装载到分离的外泌体中)[5]。
内源性可以细分为两种方法:
第一种,药物与亲代细胞共培养,并且天然存在于分泌的外泌体中。然而,获得的转染效率较低,因此该方法主要用于细胞毒性低的化学药物[6]。
第二种,用脂质体转染等化学方法转染亲代细胞以携带药物,这种方法主要用于基因药物,基因药物可以转染到亲代细胞中以过量表达其感兴趣的元件,这些元件随后被转移到外泌体中并在靶细胞中发挥作用[7]。
外源性方法主要包括:
1)药物与提取的外泌体的共培养(对于化学药物),此装载药物的范围通常仅限于疏水性化合物[8]。
2)使用物理方法将药物转移到外泌体中。一种常见物理方法是电穿孔,可以使用弱电流脉冲将电荷加载到外泌体中,通过破坏磷脂双分子层而形成可恢复的孔来促进药物加载[9]。其他物理策略,如低渗透析、皂苷孵育、挤压、超声处理、pH中和和冻融循环,也已用于将外源性治疗药物装载到外泌体中[10]。
3)通过化学(例如脂质体)转染方法将药物直接转移到外泌体中。在这种情况下,使用转染试剂或渗透剂来促进药物进入外泌体而不破坏脂质双层结构。例如,已经证明声学流体是一种将药物载入溶剂的快速而有效的方法。

3、外泌体表面修饰技术
表面修饰赋予了外泌体独特的功能,例如通过遗传操作靶向肽或位点进行化学修饰[11]。
与药物装载类似,表面功能化可分为内源功能化和外源功能化。
1)内源性方法可以通过编码这些分子的载体转染细胞来对外泌体表面进行基因工程改造,以携带特定的肽或配体[12]。此外,外泌体可以使用生物正交化学进行内源修饰,其特征在于高效率和可再现性。
2)与内源性方法相反,外源性表面修饰是通过物理和化学方法直接在外泌体膜上进行。物理方法包括挤压、超声波处理和冻融循环[13]。化学方法包括将外泌体脂质或蛋白质构建体与不同的连接基团共价结合,以实现各种功能,例如硫醇-马来酰亚胺[14]和叠氮炔环加成[15](图2)。

△图2 外泌体工程化策略
由于外泌体可以穿透血脑屏障的天然优势及其治疗潜力,且具有高生物相容性、低免疫原性、高药物递送效率、易于修饰和易于工业化等优点,其作为治疗多种疾病的新一代药物递送系统已经引起了关注。但是靶向效率低、治疗效果不均匀和产量低这些挑战依然存在。因此,需要先进的工程技术来使外泌体功能化,从而提高其作为治疗剂的效率和效力。
由此可见,工程化的外泌体可以成为疾病临床应用领域的一把“利刃”!
—
参考文献

