发布时间:2023-07-19 浏览量:0
近年来,乳腺癌已成为对妇女健康危害最严重的肿瘤之一,每年大约有数十万人死于乳腺癌。
根据2020年数据显示,目前在全球范围内,乳腺癌新增人数达226万,已超过肺癌,成为全球发病人数最多的肿瘤。尽管早筛技术和诊疗方式的进步提高了乳腺癌患者的生存率和生活质量,但是由于耐药性的出现,晚期乳腺癌患者的死亡率仍旧很高。
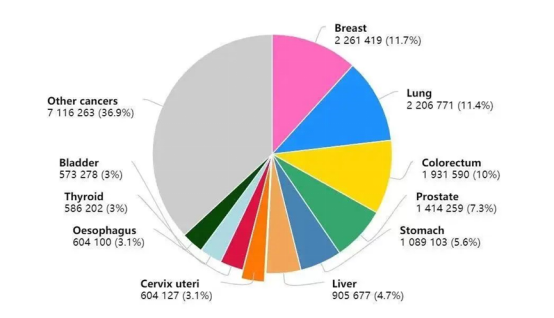
△2020年癌症新发病例数前十的癌症类型
2013 年肿瘤免疫治疗被评为世界十大科技突破之首,继2017 年美国FDA批准两款CD19 CAR-T细胞药品上市,后续又有6款CAR-T上市用于治疗血液瘤,肿瘤细胞免疫治疗成为传统治疗手段之外最具价值和发展潜力的治疗手段。
面对来势汹汹的乳腺癌,医学专家们也在积极开发新的治疗方式,其中CAR-T疗法就是重要的治疗方式之一。
CAR-T细胞靶点分为两类:肿瘤特异性抗原(TSA)和肿瘤相关性抗原(TAA)。由于肿瘤特异性抗原较为缺少,目前报道的实体肿瘤CAR-T细胞临床试验大多都围绕着肿瘤相关性抗原构建,其中包括间皮素(MSLN)、神经节苷脂 2(GD2)、人类表皮生长因子受体2(Her-2)、癌胚抗原(CEA)、前列腺特异性膜抗原(PSMA)等。
随着不同靶点 CAR-T细胞临床试验的进展,实体瘤中的肿瘤靶点选择被认为有更多重要的作用。乳腺癌也是一种异质性很强的疾病,对于包括TNBC在内的没有ERBB2和HR表达的组织,寻找有效靶点,是亟待解决的难题。
目前已有一些临床前实验显示CAR-T对乳腺癌治疗具有积极的疗效,也有多项CAR-T 治疗乳腺癌的临床试验正在各自开展中。
本文对目前用于治疗乳腺癌的潜在靶点进行盘点归纳,希望能为乳腺癌的治疗提供一些思路。
临床试验中CAR-T治疗乳腺癌的潜在靶点总结如下表:
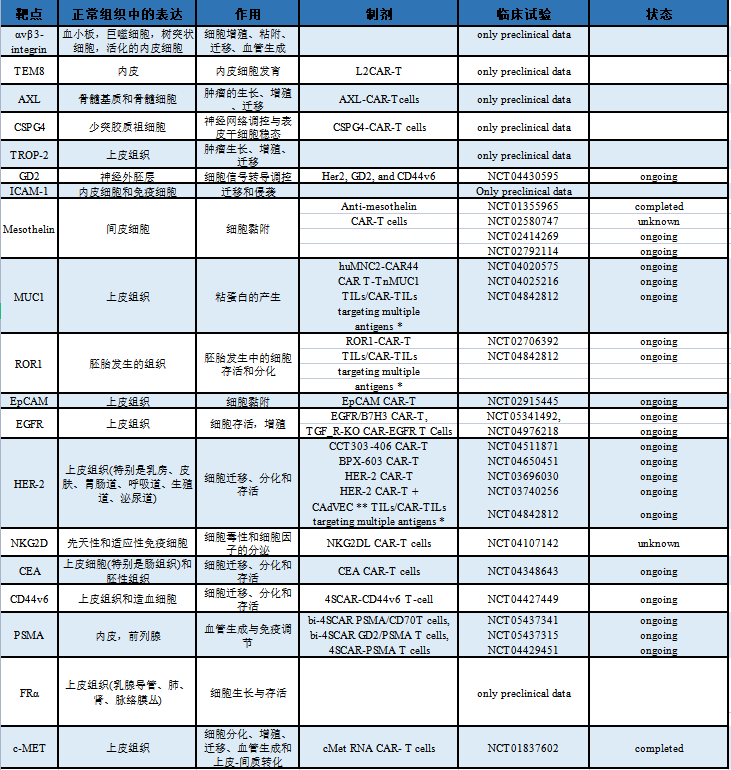
【释义】
*靶向HER2、Mesothelin、PSCA、MUC1、Lewis-Y、GPC3、AXL、EGFR、Claudin18.2/6、ROR1、GD1或B7-H3的TILs和CAR-TILs。
**CAdVEC是一种溶瘤腺病毒,旨在帮助免疫系统,包括HER2特异性CAR-T细胞,对肿瘤作出反应。
表格引自 Giuseppe Schepisi,etal.,2023.
乳腺癌根据分子表型临床上分为三种亚型:Luminal型乳腺癌,HER-2阳性乳腺癌和三阴型乳腺癌。
CAR-T与HER-2阳性乳腺癌
其中HER-2阳性的患者占到了大约20%-30%。该亚型对内分泌治疗不敏感,预后差,在乳腺癌中排名第二。HER-2水平升高与乳腺癌患者的生存率降低有关,因此靶向HER2 的CAR-T 疗法在乳腺癌的CAR-T 治疗中起着非常重要的作用。
2014年,Sun等以HER-2为靶点制备CAR-T细胞,体外杀伤HER-2+乳腺癌细胞(SKBR3、MCF-7和T47D细胞系),抑制皮下移植小鼠SKBR3细胞的肿瘤生长。在HER-2转基因小鼠中观察到对乳腺癌的抑制作用。HER-2 CAR-T细胞聚集在原发病灶,多次输注后可抑制复发和转移。
Szoor等人发现靶向HER-2 CAR-T细胞穿透肿瘤细胞球引起细胞毒性,抑制含有曲妥珠单抗耐药乳腺癌细胞(MDA-HER-2)的小鼠的生长。
然而目前靶向HER-2 的CAR-T 治疗临床试验大多是针对胶质母细胞瘤,针对乳腺癌的临床试验结果尚未公开。其中一项临床研究(NCT04650451)评估HER-2特异性双开关CAR-T细胞BPX-603 BPX-603与rimiducid一起应用于先前治疗过的HER-2扩增/过表达的局部晚期或转移性实体瘤患者,评估CAR-T的有效性和安全性,预计研究完成日期为2025年1月2日。
另一项研究是在晚期HER-2阳性实体瘤患者中进行的溶瘤腺病毒联合HER-2CAR-T细胞的治疗,试验已经招募了45名HER-2阳性肿瘤患者,预计研究完成日期为2038年12月30日(NCT03740256)。
这些临床试验可能会为乳腺癌脑转移患者带来康复的解决方案。
CAR-T与三阴乳腺癌
三阴乳腺癌作为其中一类独立亚型,是指雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)三者均为阴性表达的乳腺癌,占全部乳腺癌的15~20%。它具有高侵袭性、易转移复发、预后差等特点,因此其患者总生存期的中位数为9~13 个月,远远低于非三阴乳腺癌患者。
在所有乳腺癌亚型中,EGFR在TNBC中的表达高于其他亚型(66.7% vs 9.1%)。林霞等发现EGFR CAR-T细胞在体外和体内对TNBC细胞的生长都有有效的特异性抑制作用。CAR-T治疗2个月后,他们观察到异种移植小鼠模型(TNBC肿瘤发生)的生存期延长(p < 0.001)并抑制肺转移。针对EGFR的临床I期研究NCT05341492纳入了30例患者(包括EGFR/ B7-H3阳性晚期肺癌和EGFR/ B7-H3阳性晚期TNBC),每例患者接受2 × 106个CAR-T细胞/kg。研究结果可为应用EGFR特异性CAR-T治疗乳腺癌提供参考。

乳腺癌病例(226例TNBC和88例非TNBC)的免疫组化染色显示TNBC中间皮素(MSLN)表达较高(分别为36%和16%)。由于MSLN在正常组织中几乎不表达,它可能是TNBC理想的CAR-T细胞治疗靶点。体外结果显示,靶向MSLN的CAR-T细胞对乳腺癌细胞具有毒性。MSLN特异性CAR-T细胞的I期临床试验显示,没有细胞因子释放综合征、神经毒性或对正常组织的毒性。另外三项使用靶向CAR-T细胞治疗乳腺癌的临床研究正在进行中:NCT02792114(转移性HER-2阴性乳腺癌)、NCT02414269(胸膜转移性乳腺癌)和NCT02580747 (TNBC)。然而,这些临床试验的结果大多尚未公开,需要更多关于MSLN-CAR-T的剂量和疗效的临床试验来证实其治疗乳腺癌的有效性。
ROR1 在胚胎中的表达量较高,但在成体细胞中的表达量有限,乳腺癌中ROR1 的高表达与预后不良有关,因而被当作CAR-T 靶点研究。在2018 年底的第41 届圣安东尼奥乳腺癌研讨会SABCS 上公布的一项研究(I 期试验的初步结果),之前接受过多种疗法的三阴乳腺癌患者在ROR1CAR-T 细胞疗法后病情稳定(1 例15 周,1 例19 周),一名患者在第一次输注后病情稳定,第二次出现持续14 周的部分应答。

但是也出现了一些问题:CAR-T细胞在输注后第14 天出现了“衰竭”的表型。TGF-β 可以抑制细胞因子的产生以及CAR-T 细胞的杀伤、增殖能力,ROR1 CAR-T 和TGF-β 受体I 激酶抑制剂SD-208 的联用可以中和TGF-β 的免疫抑制作用,改善CAR-T 的效果。
c-Met 是在乳腺癌等多种实体瘤中表达的细胞表面蛋白酪氨酸激酶,研究发现c-Met在50%的乳腺癌中表达。单价抗c-Met 抗体Onartuzumab 已在临床试验中对多种晚期实体癌患者进行了疗效测试。有研究团队利用mRNA 制备CAR-T技术开展了该靶点在三阴乳腺癌中的研究(NCT01837602),该结果表明c-Met CAR-T可以输送入实体肿瘤部位,耐受性良好并在肿瘤内引起炎症反应。这一结果可为实体瘤的治疗提供参考。
总而言之,近年来针对乳腺癌的CAR-T细胞疗法临床试验尽管注册较多,但是少有结果发表,需要更多的研究来验证和比较乳腺癌不同靶标的有效性。尽管在实体瘤上的临床应用会面临一些极大的挑战,但依旧期待CAR-T疗法在不远的将来会在实体瘤中提高疗效。
【参考文献】
1. Giuseppe Schepisi, Caterina Gianni, Michela Palleschi, etal. The New Frontier of Immunotherapy: Chimeric Antigen Receptor T (CAR-T) Cell and Macrophage (CAR-M) Therapy against Breast Cancer [J]. Cancers, 2023,15(5),10.3390/cancers15051597.
2. Li Yin, Gui-Lai Chen , Zhuo Xiang, etal. Current progress in chimeric antigen receptor-modified T cells for the treatment of metastatic breast cancer [J]. Biomed Pharmacother, 2023 Jun;162:114648. doi: 10.1016/j.biopha.2023.114648.
3. Julia Tchou ,Yangbing Zhao, Bruce L Levine, etal. Safety and efficacy of intratumoral injections of chimeric antigen receptor (CAR) T cells in metastatic breast cancer[J]. Cancer Immunol Res. 2017,5(12): 1152–1161.


