发布时间:2025-07-15 浏览量:0
前言
INTRODUCTION
近年来,CAR-T细胞疗法在血液肿瘤治疗中取得了突破性进展,但当面对实体瘤时,这一疗法却遭遇了重重阻碍——脱靶毒性、T细胞耗竭和持久性不足等问题一直困扰着科学家们。近日,《Cell》期刊发表了一项突破性研究——南加州大学王英晓团队开发的"声遗传调控的CAR-T细胞"(EchoBack-CAR T),取得了突破性的进展!

超声遥控-超灵敏"热感应开关":Sort-seq筛选平台
研究团队面临的第一个挑战是如何找到足够灵敏的"热感应开关"——即能够在温和超声加热下高效启动CAR表达的启动子。传统方法通过理性设计或单点突变优化启动子,但效果有限。
为此,研究人员开发了"Sort-seq"平台:首先构建包含16,384种变体的热休克元件(HSE)文库,然后从海量变异中筛选出了性能最佳的启动子(克隆#4)。测试显示,这种"热感应开关"对短脉冲刺激(如43°C 15分钟或 43°C 1.5分钟)的响应强度是传统热休克启动子的4.32/5.88倍,而在正常体温下几乎无泄漏,为临床应用提供了安全窗口。
智能"回声反馈"系统:
让CAR-T自我维持
第二个创新是设计了独特的正反馈回路。研究人员发现,传统的可控CAR-T细胞在接触肿瘤后,CAR表达会迅速下降(24小时内完全消失),严重影响治疗效果。
团队尝试了多种反馈设计,最终研究者在启动子区域整合了对MAPK与cAMP信号敏感的CRE(cAMP响应元件)与SRE(血清响应元件),并与NFAT、NF-κB及YB-TATA组成组合启动子,用于调控包含CD28共刺激结构域的CAR表达(反馈设计#4)。这种结构能够将CAR表面表达维持在高水平长达3天以上。CAR-T 细胞一旦识别肿瘤,其激活信号(例如NFAT、NF-κB通路)会被转化为持续生产 CAR 的指令,形成正反馈循环。就像给CAR-T细胞安装了"杀敌经验值系统"——打得越多,战斗力越强!
该设计的三大突破性优势:
1.精准时空控制:通过外部聚焦超声(FUS)刺激,仅在肿瘤部位激活CAR表达,避免对健康组织的误伤。
2.持久战斗力:独特的反馈机制使CAR表达时间延长至3天以上(传统可控CAR仅能维持不到1天)。
研究团队在胶质母细胞瘤和前列腺癌模型中验证了惊人效果。
胶质母细胞瘤("脑癌之王")
在皮下胶质母细胞瘤模型中,经过两次FUS激活的EchoBack-hGD2CAR T细胞几乎完全抑制了肿瘤生长,显著延长小鼠生存期。更重要的是,在更具挑战性的原位脑瘤模型中,EchoBack-CAR T细胞表现出色:
传统CAR-T组:初期有效但13天后肿瘤复发
EchoBack-CAR组:实现了持续有效的肿瘤抑制
安全性:组织学检查显示,治疗组小鼠心脏、肝脏、脾脏、肺和肾脏等重要器官均未发现毒性迹象。
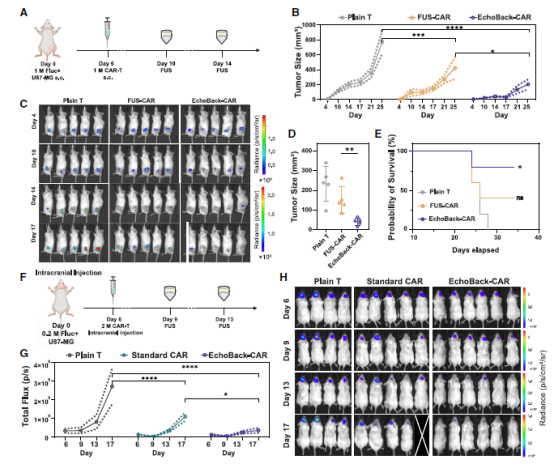
图2 EchoBack-hGD2CAR T 体内杀伤胶质母细胞瘤
前列腺癌(PSMA靶向)
为验证EchoBack平台的通用性,研究团队将其应用于靶向PSMA的前列腺癌CAR-T细胞(EchoBack-PSMACAR)。值得注意的是,PSMA在正常肾脏、小肠和膀胱中也有表达,传统CAR-T可能导致严重副作用。
实验结果显示:双侧肿瘤模型(模拟原发肿瘤和表达相同抗原的正常组织)中,传统PSMA CAR-T攻击了所有PSMA阳性组织,而EchoBack-PSM-ACAR仅清除目标肿瘤,保护了"模拟正常组织"的远端肿瘤。疗效比传统超声诱导CAR-T杀伤效率提高3倍,且高烧模拟实验(40°C)下仍无脱靶毒性。
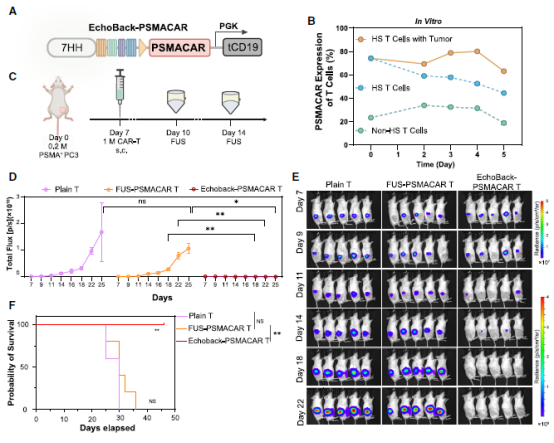
图3 EchoBack-PSMACAR T细胞体内杀伤前列腺癌
通过单细胞测序(scRNA-seq),团队揭开了EchoBack-CAR的"超能力"秘密:
1.细胞组成:EchoBack-CAR中CD8+ T细胞比例显著增高(记忆CD8+T细胞、高细胞毒性效应CD8+T细胞和增殖效应CD8+T细胞富集)
2.基因表达:与T细胞存活、增殖、效应功能和浸润相关的基因上调,而抑制/耗竭相关基因下调
3.信号通路:IL信号、mTOR信号、JAK-STAT信号和GM-CSF信号通路被激活
4.耗竭标志:传统CAR-T中PD-1/LAG-3双阳性细胞比例高达60%,约为EchoBack-CAR的2倍。
传统CAR-T是"一次性电池",而EchoBack-CAR像"太阳能电池"——间歇性超声激活相当于"充电休息",避免过度耗竭。
这项研究为CAR-T治疗实体瘤开辟了新途径:
1.安全性提升:时空控制大大降低脱靶毒性,使更多抗原靶点成为可能。
2.模块化平台:已成功应用于GD2阳性胶质母细胞瘤和PSMA阳性前列腺癌,可扩展至其他实体瘤。
3.临床应用便利:聚焦超声是非侵入性临床成熟技术,便于转化;

从"不可控"到"精准遥控",从"昙花一现"到"持久作战",EchoBack-CAR代表了一种全新的治疗范式。或许不久的将来,医生只需按下超声按钮,就能指挥CAR-T细胞大军对肿瘤发起精准打击——而这,正是精准医疗的终极梦想。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。

