发布时间:2026-01-16 浏览量:0
前言
INTRODUCTION
国际期刊《细胞》发表了一国外科研团队的重磅研究,揭示了高脂饮食的隐藏风险:长期高脂饮食带来的代谢压力,会让肝细胞为了存活 “放弃本职、逆向生长”,这背后,是肝癌风险的大幅飙升!

我们的肝脏就像身体的 “代谢中枢”,处理脂肪、合成营养,维持身体正常运转。但长期高脂饮食会给肝脏带来持续的 “代谢压力”:脂肪堆积、炎症爆发,一步步诱发代谢相关脂肪性肝病(MA-SLD),甚至进展为脂肪性肝炎(MASH),而这些都是肝癌(HCC)的重要诱因。

科研团队的科学家们通过高脂饮食(HFD)小鼠模型,追踪了肝细胞在疾病进展中的变化。面对持续的高压环境,肝细胞做出了 “妥协”:为了活下去,主动放弃了部分核心功能。
通过分析肝细胞的基因表达和表观遗传变化,研究者发现:长期代谢应激下,肝细胞中 “抗凋亡、保存活” 的基因被大量激活,而负责脂肪代谢、营养合成的关键基因(比如多种代谢酶、分泌蛋白)却显著沉默。简单说,肝细胞不再专注于 “代谢工作”,而是把所有精力都用在 “活下去” 上,这种 “保命优先” 的策略,短期内能让细胞在高压中存活,但长期来看,却彻底打乱了肝脏的正常秩序。
研究者还发现了一个关键信号:一种名为 HM-GCS2 的酶,在高脂饮食诱导下会逐渐 “沉默”,而它的低表达,正是肝癌的重要预警。HMGCS2 是身体合成酮体的 “限速酶”,酮体是脂肪代谢的重要产物,而这种酶的沉默,意味着肝细胞的脂肪代谢功能已经严重受损。
更危险的是,研究者在小鼠实验中发现:敲除 HMGCS2 基因后,肝细胞的应激反应会加速,肝癌的发展也变得更快。更让人警惕的是,这一发现同样适用于人类。研究者分析了三个人类队列的数据后证实:在尚未发生癌变的肝组织中,如果 HMGCS2 表达减少,未来 15 年内患上肝癌的风险会显著增加!这意味着,通过检测这种酶的表达水平,或许能提前预警肝癌风险,为干预争取时间。
这篇研究,再次敲响了警钟:长期高脂饮食带来的不仅是体重增加、脂肪肝,更是肝细胞功能的不可逆损伤和癌变风险的飙升。
nature杂志也发过表题为Hepatocellular se-nescence induces multiorgan senescence and dysfunction via TGFβ的文章,公布的研究结果显示,肝细胞衰老释放的因子通过TGFβ通路扩散到肝脏以外的器官,诱发肾脏等器官的衰老和功能障碍,进一步加剧病情。同时,试验证明阻断体内 TGFβ通路可抑制衰老传播到其他器官,从而防止肝脏衰老引起的肾功能障碍。

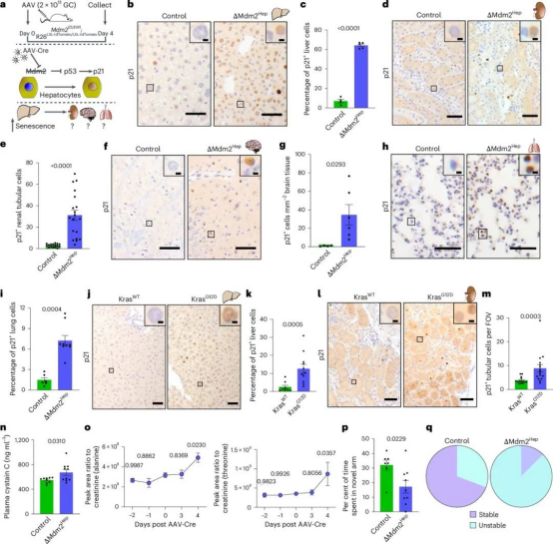
研究人员构建了一种特殊的小鼠模型(肝脏中缺失MDM2基因)对30236个单细胞转录组进行分析,发现当这个基因在肝脏中被切除时,p53在肝细胞内积累,细胞周期抑制因子p21上调(p21是衰老的一个关键标志)。通过这些改变,肝脏开始表现出衰老的特征(如β-半乳糖苷酶(SA β-Gal)活性增加),这是衰老细胞的一个常见特征。
研究人员还发现,这些衰老的标志不仅出现在肝脏,也扩展到了肾脏、大脑和肺部,表明:由于肝脏的衰老,导致多个器官连带衰老。器官功能障碍(疾病),与肝细胞衰老的传递有直接关系。
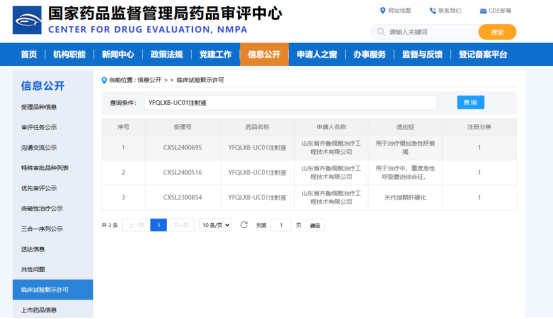
目前干细胞应对肝病方向在临床研究及转化上取得了多项成果,包括突破性临床研究结论、干细胞研究项目备案、项目启动及招募患者等。2024年3月齐鲁细胞首款针对失代偿期肝硬化的干细胞药物获批IND,成功召开项目启动会后,并于7月首例受试者入组,过程顺利。25年1月2日,齐鲁细胞又一项适应症为慢加急性肝衰竭IND再次获批。
现阶段越来越多的临床试验进一步证实了间充质干细胞在应对肝脏疾病方面的作用,大量临床前实验证实MSC可以促进肝脏再生,这似乎是应对肝脏疾病的一种有前途、潜力的方法。
对于我们普通人来说,守护肝脏的关键其实很简单:
远离长期高脂、高糖饮食,减少炸鸡、烧烤、奶茶、肥肉的摄入,均衡搭配蔬菜、水果和优质蛋白;
定期体检关注肝功能,尤其是已经出现脂肪肝的人群,更要重视随访,必要时检测相关基因或酶的表达;
控制体重、适度运动,帮助肝脏减轻代谢压力,降低炎症风险。
肝脏的 “沉默” 往往让我们忽视它的损伤,但肝细胞的每一次 “妥协”,都可能在未来埋下健康隐患。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。

