发布时间:2026-01-08 浏览量:0
前言
INTRODUCTION
心血管疾病一般起病隐匿,很多人无明显症状,一旦遇到突发情况,症状马上发生。剧烈的心前区疼痛、胸骨后疼痛、胸闷、气短、大汗、恶心、呕吐、放射性左上肢或颈部疼痛等,及时送医、及时的抢救非常重要。

目前多采用再灌注治疗,然而这些治疗并不能预防由于心肌缺血/再灌注(I / R)损伤引起的心肌细胞死亡。这种I / R损伤也可能导致心脏纤维化、心肌重塑、心律失常并最终导致心力衰竭。
仍有部分患者因血管病变弥漫、合并症复杂等原因无法获得有效救治,面临着持续心绞痛、心力衰竭等困境。在全球范围内,尤其是冠心病一类的心血管疾病始终是威胁人类生命健康的 “头号杀手”,
近期,一篇发表于《International Journal of M-olecular Sciences》(《国际分子科学杂志》)的综述《Therapeutic Potential and Mec-hanisms of Mesenchymal Stem Cells in Coro-nary Artery Disease》,为这一难题的解决带来了新的曙光。

该研究由来多个国家科研机构的团队联合完成,系统梳理了间充质干细胞(MSC)在冠心病治疗中的治疗潜力、作用机制、临床应用及未来方向,为再生医学在心血管领域的应用提供了全面参考。
不只是应对冠心病,干细胞及其外泌体以丰富的应用方式在多种心血管相关疾病研究中,均有亮眼的表现。
01
关于安全性相关的研究
在多种动物模型实验中都表明间充质干细胞治疗缺血性心脏病具有良好的效果。自2011年以来,开展了多项关于间充质干细胞治疗缺血性心脏病的临床研究,并取得了一些积极有效的结果。
同时数据表明间充质干细胞治疗缺血性心脏病具有很高的安全性,在一项包含有轻度、中度至重度心绞痛的31名患者实验中。间充质干细胞通过心肌内注射递送至体内,所有实验者接受6个月的随访。期间没有出现与细胞实验相关的室性心律失常或其他主要不良心脏事件。
02
干细胞外泌体与心肌梗死
根据心血管领域Top期刊《Circulation》刊文,雾化吸入外泌体可有效改善心肌梗死后心肌重塑。

该项研究来自美国哥伦比亚大学,研究者报告了一种心肌梗死 (MI) 后通过吸入输送外泌体的无创、可重复的方法,即干细胞外泌体雾化疗法 (SCENT)。这项研究让人们对干细胞外泌体雾化的临床应用前景有了更为广阔的认识。
为了确定吸入的外泌体是否能够被递送至心肌,研究人员检测了吸入的外泌体在小鼠体内的分布情况。
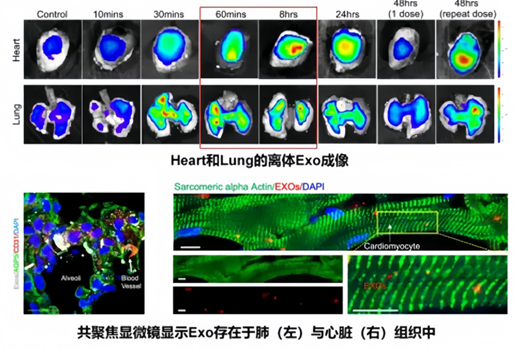
检测显示,吸入的外泌体在10至60分钟内迅速聚集在肺部与心脏。值得注意的是,在60分钟时,外泌体开始在心脏中累积,这种累积与肺部信号的减少同时发生;这表明外泌体持续穿过肺泡毛细血管屏障,被损伤的心肌募集。重复给药能够使得48小时后在心脏中仍然保留大量的外泌体。
研究结论:在心肌梗死后的心肌重塑过程中,外泌体发挥着重要作用。它们携带心肌细胞所需的生长因子、修复因子等关键物质,促进心肌细胞的增殖和分化。同时,外泌体还能调节心肌细胞的代谢和能量供应,提高心肌的收缩力和抗缺氧能力。这些效应共同促进了心肌重塑的逆转和心脏功能的恢复。

这些结果为雾化吸入外泌体治疗心肌梗死提供了有力的证据支持。
03
炎症性心肌病

众多基础和临床实验表明,炎症性心肌病可能存在免疫功能紊乱,这使MSCs治疗该疾患时具有独特优势。有实验证实,MSCs通过心肌内注射或静脉输注的方法,可减少心肌损伤和功能紊乱。
因此,间充质干细胞移植可能具有改善心功能的作用,这项研究进展对于MSCs在治疗炎症性心肌病时如何实现跨血管转运及静脉应用MSCs的可行性进行了详细的综述。
目前,有许多与干细胞相关的临床试验项目,亮眼的研究结果,使其被认为是心肌修复和再生领域的一种有前途的临床应用手段。
干细胞,尤其是间充质干细胞,为心脏疾病的临床应用研究方向带来了全新的方法。随着全球临床研究团队的不断探索与努力,干细胞必将改变心脏疾病的临床应用格局,为有需求的人带来希望。随着研究的开展,未来将临床试验转化为临床实践是值得期待的,有望改变心血管疾病患者的管理和整体预后
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。

